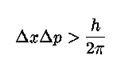TEORIJA ATOMA I KVANTNA FIZIKA
1 Atomska teorija
Još u petom stoljeću p.n.e. Demokrit iznosi hipotezu da je materija sastavljena od sitnih neuništivih jedinica koje naziva atomima. Sami atomi ostaju neizmjenjeni, ali se kreću prostorom i kombiniraju na različite načine te formiraju makroskopske objekte.Iako je Demokritova dilema bila u osnovi filozofske naravi, činjenica da u Svemiru postoji neka elementarna tvar je osnovni pokretač moderne fizike (potraga za konačnim subatomskim česticama).
John Dalton u ranim 1800-im zaključuje da se svaki kemijski element sastoji od jedinstvenih tipova atoma, te da se atomi međusobno razlikuju s obzirom na njihovu masu. Izradio je sistem kemijskih simbola i nakon što je ustanovio relativne težine atoma poredao ih je u tablicu. Utvrdio je da su tvari sastavljene od molekula i da se molekule sastoje od atoma sa točno određenim međusobnim rasporedom. Zbog toga, atomi određuju sastav tvari, a složene tvari se mogu razložiti na njihove elementarne elemente.
Prvu procjenu veličine atoma i broja atoma po jedinici volumena napravio je Joseph Loschmidt 1985. Loschmidt je izračunao da u 12g ugljika postoji 6.022×1012 atoma i da je tipičan promjer atoma 10-8 centimetara.
2 Materija
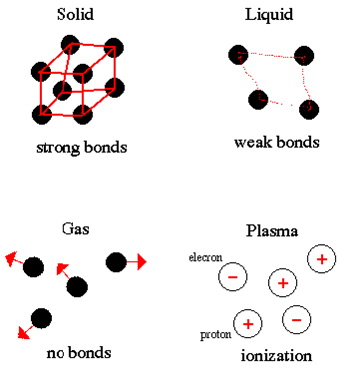
Materija egzistira u četiri stanja: čvrsto, tekuće, plinovito i kao plazma. Plazmu je moguće pronaći samo u koronama (kruni ili vijencu) i središtima zvijezda. Stanje tvari je određeno snagom veza između atoma koji čine tvar. Dakle, proporcionalno je temperaturi ili količini energije koja je sadržana u tvari.
Promjena stanja tvari iz jednog u drugo naziva se promjena faze. Primjer: led (čvrsta voda) prelazi u tekuću vodu dodavanjem energije. Nastavimo li dodavati energiju i voda uzavre prelazi u plinovito stanje (plinovita voda) zatim na nekoliko milijuna stupnjeva dolazi do raspada na komponente – atome.
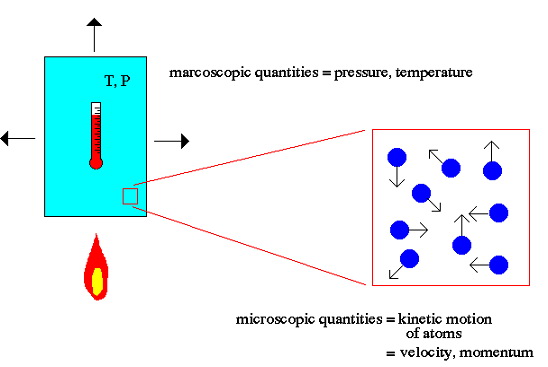
Temeljno je uočiti da atomska teorija dovodi u odnos makroskopski svijet (nas) i mikroskopski svijet atoma. Primjer: da bi se objasnila tvar u makroskopskom svijetu koriste se koncepti kao što su temperatura i pritisak. U mikroskopskom svijetu atomska teorija se bavi kinetikom atoma koji se kreću kako bi objasnila makroskopske veličine. Tako se temperatura objašnjava kretanjem atoma (brže = toplije). Pritisak se objašnjava momentom atoma koji se kreću i koji se prenosi na stijenke posude (brži atomi = viša temperatura = više momenta/sudara = viši pritisak).
3 Zakon idealnog plina
Makroskopska svojstva tvari su određena kemijskim zakonom idealnog plina.
Idealni plin je plin koji se na ponaša (na idealan način) u skladu sa fizikalnim zakonima između pritiska, volumena i temparature. Zakon idealnog plina kaže da je za točno određenu količinu plina, produkt volumena (V) i pritiska (P) proporcionalan apsolutnoj temperaturi (T), odnosno u obliku formule: PV=kT , gdje je k konstanta. Ova relacija za neku tvar naziva se relacijom stanja i dovoljna je da se objasni veliki dio ponašanja tvari.Zakon idelanog plina se može izvesti i iz kinetičke teorije plinova i temelji se na pretpostavci da:
1. se plin sastoji od velikog broja molekula, koje se kreću po slučajnim pravcima i u skladu sa Newtonovim determinističkim zakonima gibanja
2. volumen molekula je zanemarivo malen u odnosu na volumen koji zauzima plin
3. na molekule ne djeluju niti jedne druge sile osim tijekom elastičnih sudara zanemarivo kratkog trajanja.
4 Termodinamika
Znanost o odnosu između topline, rada, temperature i energije, a koja obuhvaća opće karakteristike ponašanja fizikalnih sistema naziva se termodinamika.Prvi zakon termodinamike često se naziva i zakon o očuvanju energije (zapravo energije mase) jer tvrdi da, kada sistem prolazi kroz proces, suma energije koja se prenosi preko granica sistema – bilo kao toplina ili kao rad – je upravo jednaka neto promjeni u energiji sistema. Primjer: ukoliko vršimo fizički rad na nekom sistemu (npr. miješamo vodu) dio energije odlazi na gibanje, a ostatak na podizanje temperature sistema.
Drugi zakon termodinamike tvrdi da, u zatvorenom sistemu entropija raste. Automobili hrđaju, mrtva stabla se raspadaju, zgrade se urušavaju, sve ove pojave su primjeri entropije na djelu, spontanog kretanja iz reda prema neredu.
Klasična Newtonova fizika je nepotpuna jer ne uključuje ireverzibilne procese koji su povezani sa povećanjem entropije. Entropija čitavog Svemira se neprestano povećava s vremenom. Mi smo jednostavno lokalna točka niske entropije i naša sudbina je vezana uz nezaustavljivo povećanje nereda u našem svijetu – zvijezde će sagorjeti, civilizacije će izumrijeti zbog nedostatka energije.
Kretanje prema ekvilibrijumu (ravnoteži) je stoga nezaustavljiv proces. Tendencija prema ravnoteži je toliko fundamentalna u fizici da je drugi zakon termodinamike vjerojatno jedan od najuniverzijalnijih regulatora aktivnosti koji je poznat u znanosti.
Koncept temperature ulazi u termodinamiku kao precizna matematička veličina koja stavlja u odnos toplinu i entropiju. Međusoban odnos ovih triju veličina je dalje ograničen trećim zakonom termodinamike, koji se bavi temperaturom apsolutne nule i koju je teoretski nemoguće dosegnuti.
Apsolutna nula (približno -273 oC) se odnosi na stanje u kojem je sistem postigao stanje vlastite najniže energije. Treći zakon tvrdi da, kako prilazimo minimalnoj temperaturi daljnja ekstrakcija energije postaje sve teža i teža.
5 Rutherfordov atom
Ernest Rudeford se smatra ocem nuklearne fizike. Možemo kazati da je Rudeford izmislio jezik kojim je moguće opisati teoretske koncepte atoma i fenomen radioaktivnosti. Čestice koje je nazvao i opisao uključuju alfa česticu, beta česticu i proton.
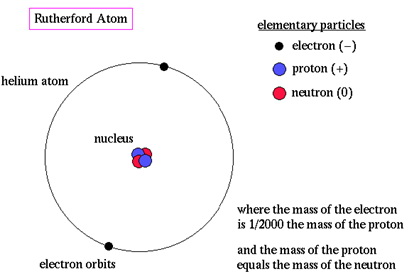
Rudefordov model opisuje atom kao sićušnu, gustu, pozitivno nabijenu jezgru nazvanu nukleus u kojoj je koncentrirana gotovo sva masa, oko koje svijetle, negativno nabijene tvari koje kruže na određenoj udaljenosti, slično kao što planeti kruže oko Sunca.
Prijevod sa slike: masa elektrona je oko 1/2000 mase protona, a masa protona je jednaka masi neutrona.
Rudefordov model atoma se naziva i nuklearnim atomom ili planetarnim modelom atoma.
6 Smjer vremena
6.1 Entropija
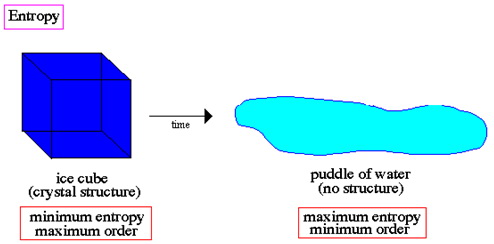
Entropija je spontano i konitinuirano kretanje iz reda prema neredu.
Mjera entropije mora biti globalna. Primjer: možemo pumpati toplinu iz frižidera (kako bi napravili kocke leda), ali toplina se prenosi u kuću i entropija kuće raste, iako se lokalna entropija u kockama leda smanjuje. Dakle, suma entropije u kući i frižideru raste.Koncept entropije se odnosi na mnoge fizikalne sisteme, ne samo na toplinu. Primjer: entropija ometa tok informacija – signal se uvijek degenerira uslijed slučajnog šuma.
Entropija čitavog Svemira raste sa vremenom.
6.2 Ireverzibilnost
Klasična fizika je znanost na kojoj se temelji naše vjerovanje u deterministički, vremenski revezibilan opis prirode. Klasična fizika ne unosi nikakvu razliku između prošlosti i budućnosti. Ovo je poznato kao Epikurova dilema, dilema postojanja ili postajanja, ideja da je potrebano uzeti u obzir određeni element slučajnosti kako bi se dogodila devijacija (odstupanje) u kretanju materije iz potpuno predodređene (staze) evolucije.Zapanjujući uspjeh jednostavnih fizikalnih principa i matematičkih pravila u razjašnjavanju velikog dijela prirode nešto je potpuno očigledno sa stanovišta svakodnevnog iskustva. Povremeno je promatrajući, priroda se čini krajnje kompleksnom i slučajnom. Malo je fenomena koji iskazuju točnu vrstu pravilnosti, a koja koji mogu nagovještavati unutrašni red. Tamo gdje su trendovi i ritmovi očiti, oni su veoma često približne i kvalitativne forme. Postavlja se pitanje kako možemo uskladiti ove naoko slučajne događaje sa pretpostavkom o Svemiru bez unutarnjih zakona.
Treba biti sposoban izdvojiti bitno iz kompleksnosti svakodnevnih situacija. Reverzibilni procesi se čine idealizacijom realnih procesa u prirodi. Interpretacije koje se temelje na vjerojatnosti čine makroskopski karakter naših opservacija odgovornim za ireverzibilnost koju promatramo. Ako bi mogli pratiti svaku pojedinu molekulu, mogli bi vidjeti vremenski reverzibilan sistem u kojem se svaka molekula ponaša u skladu sa Newton-ovim zakonima fizike. Kako mi jedino možemo opisati određeni broj molekula u svakom odjeljku, zaključujemo da sistem teži prema ekvililibrijumu (ravnoteži). Da li je ireverzibilnost samo posljedica približnog makroskopskog karaktera naših promatranja? Da li ona ima ima veze sa ignoriranjem svih pozicija i brzina?
Ireverzibilnost vodi i prema redu i prema neredu. Neravnoteža vodi prema konceptu kao što je samo-organizacija i disipativne strukture (one strukture koje se postepeno troše, gube energiju, rasipaju) kao što je npr. snježna pahuljica. Objekti daleko od ravnoteže su visoko organizirani zahvaljujući privremenim, ireverzibilnim, neravnoternim procesima.
Ponašanje kompleksnog sistema nije u potpunosti slučajno, radi se zapravo o tome da je finalno stanje toliko osjetljivo na početne uvjete da je nemoguće predvidjeti buduće ponašanje bez beskonačnog znanja o svim budućim kretanjima i energijama (npr. leptir u Južnoj Americi uzrokuje oluju na Sjevernom Atlantiku).
Promatramo li rast jednodimenzionalnog staničnog automata da dva stanja (on i off) očito je da jednostavna pravila generiraju značajnu kompleksnost. Iako se radi „samo“ o matematičkoj igri, mnogo je primjera istog oblika i složenog ponašanja koja se zbivaju u prirodi.
Individualni opisi nazivaju se trajektorije, statistički opis grupa naziva se ansamblom. Individualni dijelovi su determinirani, trajektorije fiksirane. Ipak ansambli djelova prate vjerojatne obrasce i nisu izvjesni (kolebljivi su). Da li ovo proizlazi iz ignoriranja svih trajektorija ili nečeg dubljeg u zakonima prirode? Svaki proračun sa ciljem predviđanja će neizbježno sadržavati neku veličinu ulaznih pogrešaka jer mi nismo u mogućnosti mjeriti fizikalne veličine neograničeno precizno.
Valja uočiti da se relativne vjerojatnosti razvijaju na determinističan način. Statistička teorija može ostati deterministička. Dakako, makroskopska ireverzibilnost je manifestacija slučajnosti vjerojatnih procesa na mikroskopskoj skali. Uspjeh redukcionizma se temeljio na činjenici da je većina jednostavnih fizikalnih sistema linearna, ukupno je suma dijelova. Kompleksnost se pojavljuje u nelinearnim sistemima.
6.3 Smjer vremena
Zašto percipiramo vrijeme kao da se uvijek kreće prema naprijed? Zašto su naša sjećanja uvjek o prošlosti, a nikada o budućnosti. Svi temeljni Newtonovi zakoni su vremenski revezibilni. Sudari izgledaju jednako prema naprijed i prema natrag. Kutija ispunjena molekulama plina koja se u potpunosti ponaša u skladu s Newtonovim zakonima nema ugrađen smjer vremena. Međutim, moguće je pokazati da će kontinuirano slučajno kretanje molekula izazvati ukupan ansambl da posjeti i prijeđe kroz svako moguće stanje kutije, slično kao što će kontinuirano miješanje karata u konačnici reproducirati svaku moguću sekvencu (slijed karata).Ova sposobnost prirode da se dijeli u višestruka stanja čini jednostavnijim za shvatiti zašto termodinamični sistemi teže ekvilibrijumu (ravnoteži) što je poznato kao Pioncare-ov teorem. Ako je kutija sa plinom trenutno u stanju niske entropije, uskoro će vjerojatno biti u stanju manjeg reda s obzirom da postoji velik broj stanja koja može zauzeti (u koja se može razviti), većina ovih stanja su ona više entropije. Samim zakonima slučajnosti, kutija ima veću vjerojatnost postići stanje više entropije nego stanje niže entropije jer postoji mnogo više mogućih stanja visoke entropije.
Poincare-ov teorem tvrdi da ukoliko svako pojedino stanje ima istu vjerojatnost da bude postignuto (dosegnuto), tada će se očito stanja većeg nereda pojavljivati češće nego stanja potpune uređenosti, jednostavno jer je ovih prvih znatno više.
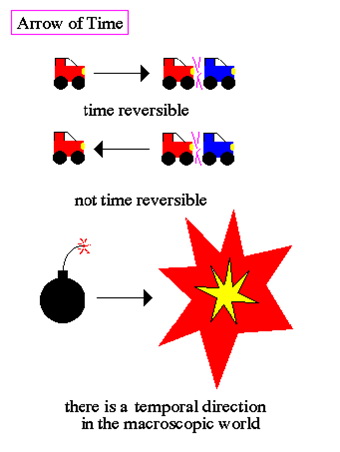
Termodinamička zbivanja, kao naprimjer rast stabla, nisu vremenski reverzibilna. Razbijena jaja se ne popravljaju sama. Određeno ovim događajima, vrijeme ima smjer, preferirani smjer.
Entropija i smjer vremena su usko povezan. Povećanje entropije je u smjeru pozitivnog vremena. Ipak, proučavanje komponenata sistema pokazuje da je djelove moguće opisati u obliku vremenski-simetričnih zakona. Drugim riječima, mikroskopski svijet je upravljan vremenski-simetričnim zakonima, ali makroskopski svijet ima točno određeni smjer.
7 Kvantna fizika
7.1 Planckova konstanta
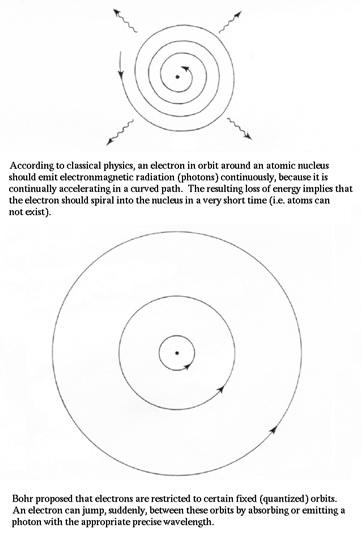
Ranih 1900-ih njemački fizičar E. Planck je uočio fatalne pogreške u fizici demonstrirajući da elektron kružeći oko jezgre ubrzava. Akceleracija znači promjenjivo električno polje (elektron ima naboj), kada dolazi do emitiranja fotona. Ali, u tom slučaju elektron bi izgubio energiju i pao na jezgru. Prema tome, atom ne bi trebao postojati.
Prijevod sa slike:Prema klasičnoj fizici, elektron u orbiti oko jezgre atoma treba emitirati elektromagnetsku radijaciju (fotone) kontinuirano, jer kontinuirano ubrzava u zakrivljenoj putanji. Rezultirajući gubitak energije implicira da bi elektron trebao u spiralnoj putanji pasti na jezgru u veoma kratkom vremenu (tj. atom ne može postojati).
Bohr je predložio da su elektroni ograničeni na određene fiksirane (kvantizirane) putanje. Elektron može skočiti, odjednom, između ovih putanja apsorbiranjem ili emitiranjem fotona sa odgovarajuće točnom valnom dužinom.Da bi riješio ovaj problem, Planck je pretpostavio da se energija, na sub-atomskoj razini, može transferirati (prenositi) jedino u malim jedinicama tzv. kvantima. Prema njegovom pronalasku, mi ovu jedinicu nazivamo Planck-ovom konstantom (h). Riječ kvantni dolazi od riječi kvantitet i odnosi se na malene pakete djelovanja ili procesa, najmane jedinice oba (djelovanja ili procesa) koji se mogu povezati sa pojedinim događajem u mikroskopskom svijetu.
7.2 Dvojnost val-čestica
Valna priroda svjetlosti objašnjava velik dio njenih svojstava:
• refleksiju/refrakciju
• difrakciju/interferenciju
• Dopplerov efekt
Ali, rezultati zvijezdane spektroskopije (emisija i apsorpcija spektra) se mogu objasniti samo ukoliko svjetlost ima čestičnu prirodu poput Bohr-ovog atoma i opisa svjetlosti pomoću fotona.
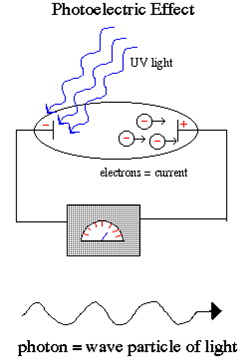
Dvojna priroda svjetlosti najbolje se demonstrira fotoelektričnim efektom, u kojem slabo UV zračenje (svjetlost) producira tok naboja (oslobađanje elektrona) dok snažno crveno svjetlo ne oslobađa elektrone bez obzira koliko je intenzivno.
Einstein je objasnio fotoelektrični efekt pretpostavljajući da svjetlost postoji u čestičnom stanju, paketima energije (kvantima) nazvanim fotoni. Upotrebom crvenog svjetla ne dolazi do toka naboja jer su paketi energije koje nosi svaki pojedini foton preslabi da bi izbili elektrone iz atoma neovisno o tome koliko je crvenih fotona usmjereno na katodu. Za razliku od toga svaki pojedini UV foton je dovoljno snažan da oslobodi elekton i prizvede tok naboja.
Ovo je jedan od najneobičnijih, ali temeljnih koncepata moderne fizike da svjetlost ima i valno i čestično stanje (ali ne istovremeno) i nazivamo ga valno-čestičnim dualizmom (dvojnosti).
7.3 de Broglie-va valna materija
Jedno do temeljnih pitanja koje se postavilo kada je Einstein iznio svoju teoriju o svjetlosti bilo je: da li elektroni imaju valna svojstva? Odgovor je došao u doktorskoj tvrdnji Louisa de Broglie-a 1923. de Broigle je tvrdio da s obzirom da svjetlost pokazuje valna i čestična svojstva i materija također može biti čestica i val.
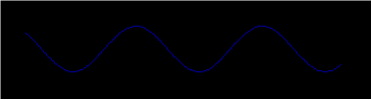
Jedan od načina na koji možemo zamisliti val tvari (ili foton) je u obliku valnog paketa. Normalni valovi imaju sinusoidalni oblik i nemaju početak ni kraj.
Kompozicija nekoliko valova različitih valnih dužina može proizvesti valni paket sljedećeg oblika (slika).
Dakle, foton ili elektron u kretanju se može zamisliti kao valni paket koji posjeduje svojstva vala, ali također i jedinstvenu poziciju i veličinu koju povezujeno sa česticom. Prisutni su i određeni problemi poput onog da valni paketi ne prestaju na konačnoj udaljenosti od točke najveće amplitude već se proteže u beskonačnost. Znači li to da elektron postoji na svim točkama svoje trajektorije?
de Broglie je također formulirao jednadžbu koja povezuje valnu dužinu čestice sa momentom čestice. Dakle, energija je povezana svojstvima tvari.
I dok je de Broglie-ove valove bilo teško prihvatiti nakon stoljeća shvaćanja čestica kao tvari s konačnom veličinom i pozicijom, valna svojstva elektrona su dokazana u laboratorijskom eksperimentu usmjeravanjem snopa elektrona prema prepreci s otvorima i pokazujući pojavu struktura koje nastaju uslijed interferencije.
Kako se de Broglie-ova ideja uklapa u makroskopski svijet? Valna dužina isčezava proporcionalno sa momenton objekta. Zato što je veća masa objekta, kraća je valna duljina. Valna dužina osobe, na primjer, je veličine milijuntnog dijela centimetra, premala da bi se mogla izmjeriti. Ovo je razlog zbog kojeg ljudi ne „tuneliraju“ kroz stolice kada na njih sjednu.
7.4 Princip neodređenosti
Klasična fizika se našla pred problemom kada je trebalo opisati dvojnu prirodu (valna i čestična svojstva) materije. Još veći problemi došli su sa otkrićem principa neodređenosti.
Princip neodređenosti razvio je W. Heisenberg tvrdnjom o efektima valne i čestične prirode na svojstva objekata na subatomskoj razini. Razmotrimo li koncept momenta u mikroskopkoskom svijetu s valnim svojstvima, moment vala dan je sa njegovom dužinom. Valni paket poput fotona ili elektrona sastavljen je od mnogo valova. Stoga, on treba biti sastavljen od mnogo pojedinačnih momenata. Ali kako objekt može imati mnogo momenata?
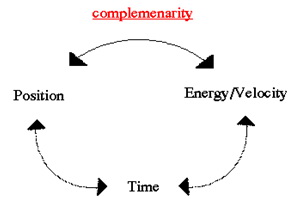
Dakako, u trenutku kada je mjerenje nad česticom provedeno, uočava se jedan jedinstveni moment. Ali poput neodređeosti pozicije (fuzzy position) i moment prije promatranja je intrinsično (po prirodi, kao unutrašnje svojstvo) neodređen. Ovo je poznato kao princip neodređenosti koji tvrdi da su određene veličine poput pozicije, energije i vremena nepoznate osim u obliku vjerojatnosti. U svojoj najjednostavnijoj formi princip neodređenosti tvrdi da pouzdano poznavanje tzv. komplementarnih parova nije moguće. Na primjer, možemo izmjeriti lokaciju elektrona, ali ne istovremeno i njegov moment (energiju).
Matematički princip neodređenosti opisujemo na sljedeći način, gdje je „x“ pozicija, a „p“ moment:
Ovo je vjerojatno najpoznatija jednadžba u fizici uz onu E=mc2. Ona u osnovi kaže da kombinacija pogreške u određenosti položaja pomnožena sa pogreškom u određenosti momenta uvijek mora biti veća od Planck-ove konstante. Dakle, moguće je izmjeriti poziciju elektrona do neke točnosti, ali pri tome će njegov moment biti unutar velikog raspona vrijednosti. Obratno, moguće je precizno izmjeriti moment, ali tada je položaj nepoznat.
Također, valja uočiti da je princip neodređenosti nevažan u slučaju makroskopskih objekata s obzirom da je Planck-ova konstanta, h, veoma mala (10-34).
Dubina principa neodređenosti se shvaća kada postavimo pitanje; da li je naše znanje uistinu neograničeno? Odgovor je ne, jer princip neodređenosti kaže da postoji ugrađena neodređenost, nedeterminiranost, nepredvidljivost prirode.
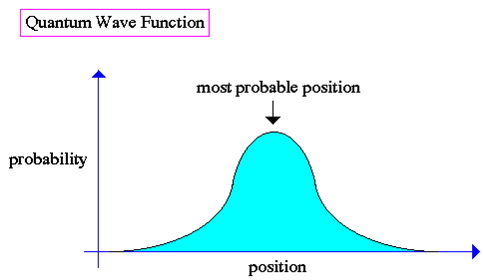
7.5 Kvantna valna funkcija
Valna priroda mikroskopskog svijeta čini koncept „položaja“ složenim u slučaju subatomskih čestica. Čak i valni paket ima „neodređenost“ koja se uz njega vezuje. Elektron u orbiti (na putanji) oko jezgre nema poziciju o kojoj možemo raspravljati, osim što možemo tvrditi da sa nalazi negdje unutar svoje orbite (putanje).Kako bi riješila ovaj problem, kvantna fizika je razvila alat u obliku kvantne valne funkcije, matematički opis superpozicije povezane sa entitetom (jedinkom) u bilo kojem trenutku.
Ključna točka valne funkcije je u tome da se pozicija čestice opisuje isključivo kao mogućnost ili vjerojatnost sve dok se ne izvrši mjerenje. Na primjer, sudar elektrona sa fotonom rezultira izmjerenom pozicijom i kažemo da je nastao „kolaps“ valne funkcije (tj. valna priroda elektrona prelazi u čestičnu prirodu).