OSTALI SEMINARSKI RADOVI
IZ HEMIJE: |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
Apsorpcioni spektri organskih reagenasa i njihovih kompleksa
Atomski i molekulski spektri
Uzajamnim dejstvom molekula saelektromagnetnim zračenja dolazi do promena, kako u molekulu tako i u samom zračenju, koje se široko koriste u analitičkoj hemiji. Eksperimentalno možemo proučavati apsorpciju zračenja, luminiscenciju, difrakciju, kružni dihroizam, itd. Hemičare pre svega interesuju apsorpcija elektromagnetnog zračenja i luminiscencija. Elektromagnetno zračenje je kombinacija oscilujućeg magnetnog i električnog polja, a predstavlja energiju koja se emituje u obliku talasa kao posledica kretanja naelektrisanih čestica. Kretanje naelektrisanja dovodo do nastanka magnetnog polja, a ako dolazi do promene kretanje (povećanja brzine)doćiće do promene samog magnetnog polja, koje zauzvrat stvara električno polje. Maxwell jepokazaodajebrzinaelektromagnetnogzračenjaistakaobrzinasvetlosti. Međutim svetlost je elektromagnetno zračenje koje zauzima samo mali deo mogućeg spektra. Različite vrste elektromagnetnog zračenja razlikuju se samo po talasnoj dužini i frekvenciji. Osobine elektromagnetnog zračenja zavise od njegove talasne dužine. Celi opseg talasnih dužina elektromagnetnog zračenja predstavlja elektromagnetni spektar i on obuhvata: gama zračenje, rentgensko zračenje, ultraljubičasto zračene, vidljivu svetlost, infracrveno zračenje, mikrotalasno zračenje i radiotalase.
Atomski spektri posmatraju se kao emisioni u oblasti talasnih dužina od 200 do 1000 nm. Atomske spektre daju neutralni atomi i atomski joni, a spektri su linijski. Zračenje u ovoj oblasti potiče od elektronskih prelaza valentnog elektrona u atomima. Za opisivanje stanja atoma u kvantnoj mehanici koristi se Šredingerova jednačina. Rešavanjem ove jednačine dobijaju se talasne funkcije (atomske orbitale) koje opisuju moguća stanja elektrona u atomu. Rezultati koji se dobijaju rešavanjem Šredingerove jednačine ukazuju da ukupna energija jednog atoma može imati smo niz određenih, diskretnih vrednosti. Svakom stanju odgovara određena vrednost energije pa u tom smislu govorimo o energetskim stanjima atoma. Sve dok se atom nalazi u stacionarnom stanju njegova energija je konstantna; on niti emituje energiju niti je apsorbuje iz okoline.Svoje energetsko stanje atom može da promeni apsorpcijom ili emisijom elektromagnetnog zračenja. Promena energetskog stanja ili nivoa naziva se prelaz. Količina energije koju atom tom prilikom emituje (ili apsorbuje) strogo je određena, kvantirana veličina. Svako stacionarno stanje atoma može se izraziti jednim skupom od četiri broja koji se nazivaju kvantni brojevi. Kvantni brojevi su povezani sa dinamičkim promenljivim koje karakterišu kretanje elektrona u atomu. Te dinamičke promenljive su ukupna energija![]() , orbitalni mehanički momenat
, orbitalni mehanički momenat ![]() , projekcija orbitalnog momenta
, projekcija orbitalnog momenta ![]() , sopstveni mehanički momenat (spin)
, sopstveni mehanički momenat (spin) ![]() , i projekcija spina
, i projekcija spina ![]() . Energija elektrona u atomu određena je glavnim kvantnim brojem
. Energija elektrona u atomu određena je glavnim kvantnim brojem ![]() . Najupadljivija pravilnost u atomskim spektrima je grupisanje linija (koje potiču od prelaza između kvantiranih energetskih nivoa) u serije.
. Najupadljivija pravilnost u atomskim spektrima je grupisanje linija (koje potiču od prelaza između kvantiranih energetskih nivoa) u serije.
Molekulski spektri se posmatraju kao apsorpcioni spektri a daju ih molekuli, molekulski joni i radikali. Molekulski spektri se znatno razlikuju od atomskih. Dok se kod atomskih spektara srećemo sa relativno malim brojem linija koje se grupišu u serije, kod molekulskih spektara imamo veliki broj linija koje su postavljene blisko jedna uz drugu tako da obrazuju trake. Zato se molekulski spektri nazivaju još i trakasti. Osim u normalnoj spektrohemijskoj oblasti (200–1000 nm), ovi spekti se javljaju i u dalekoj infracrvenoj i mikrotalasnoj oblasti, sa dugotalasne strane spektra, kao i u dalekoj i vakuumskoj UV oblasti sa kratkotalasne strane spektra. Složenost molekulskih spektara (njihova trakasta struktura) uslovljena je složenošću kretanja čestica koje obrazuju molekul. Zanemarujući translaciono kretanje molekula kao celine, koje na izgled molekula utiče samo u maloj meri, u molekulu razlikujemo kretanje valentnih elektrona, kretanje jezgra atoma koje dovodi do periodične promene njihovog relativnog položaja (oscilacije atoma u molekulu), a takođe i periodičnu promenu orijentacije molekula kao celine u prostoru (rotacija molekula). Sva ova kretanja su spektralno aktivna i na taj način doprinose konačnom izgledu spektra. Svako od navedenih kretanja karakteriše se određenom ukupnom energijom. Kao aproksimacija uzima se da ukupnu energiju molekula ![]() , u jednom njegovom stacionarnom stanju, možemo približno, predstaviti u obliku zbira energija elektronskog,
, u jednom njegovom stacionarnom stanju, možemo približno, predstaviti u obliku zbira energija elektronskog, ![]() , oscilatornog (vibracionog)
, oscilatornog (vibracionog)![]() , i rotacionog
, i rotacionog ![]() , kretanja, tj.
, kretanja, tj.
![]()
Saglasno rezultatima kvantne teorije molekula, sva tri oblika energije molekula mogu imati samo diskretne, kvantirane vrednosti. Zahvaljujućuvelikoj razlici u pojedinim oblicima energije možemo svaki oblik energije kvantirati posebno; prvo elektronsku, zatim oscilatornu pri zadatoj vrednosti elektronske energije, i najzad rotacionu, pri zadatoj vrednosti oscilatorne i elektronske energije. To dalje znači da svakoj vrednosti elektronske energije odgovara niz diskretnih vrednosti oscilatorne energije, a svakoj oscilatornoj energiji niz vrednosti rotacione energije. Kako su energetski nivoi u molekulu kvantirani, apsorpcija svetlosti nije kontinualna funkcija njegove energije; do apsorpcije svetlosti može doći onda kada je energija upadnog zračenja jednaka energetskoj razlici između energetskih nivoa molekula:
![]()
U svakom molekulu postoji veliki broj energetskih nivoa, međutim prelazi između nivoa posmatraju se samo za neka od više mogućih energetskih stanja. Zahtevi koje moraju da zadovolje energetska stanja da bi uopšte došlo do energetskih prelaza, određeni su pravilima izbora. Saglasno ovom principu postoje dozvoljeni i zabranjeni prelazi. Osnovna razlika između ova dva tipa prelaza je u njihovom relativnom intenzitetu.
Saglasno klasičnoj teoriji elektromagnetizma, do apsorpcije elektromagnetnog zračenja može doći samo onda kada je molekul električni dipol, koji može da interaguje sa električnom komponentom propuštenog zračenja. Međutim ovaj uslov nije ograničen na molekule sa permanentnim električnim dipolom. Isto tako moguće je indukovati dipol u molekulu, u samom trenutku međusobne interakcije molekula sa zračenjem, ili usled promene simetrije molekula kao posledice promenljivog oscilovanja atomskih jezgara. Usled apsorpcije zračenja energija molekula raste; molekul prelazi iz stanja niže energije (![]() ) u stanje više energije (
) u stanje više energije (![]() ). Po Planku energija elektromagnetnog zračenja je povezana sa njegovom frekvencijom ν i talasnom dužinom λ na sledeći način:
). Po Planku energija elektromagnetnog zračenja je povezana sa njegovom frekvencijom ν i talasnom dužinom λ na sledeći način:
![]()
gde je h–Plankova konstanta ![]() ,
a c–brzina svetlosti u vakuumu
,
a c–brzina svetlosti u vakuumu ![]() .
.
Kada se molekul nađe u polju elektromagnetnog zračenja onda, pod određenim
uslovima, dolazi do apsorpcije zračenja, a kao rezultata toga molekul
prelazi iz stanja niže energije (obično osnovnog stanja) u stanje više
energije (pobuđeno ili ekscitovano stanje). Elektronski molekulski spektri
nastaju kvantiranim prelazom elektrona koji učestvuju u hemijskoj vezi
ili nesparenih valentnih elektrona, između različitih energetskih stanja.
Mehanizam nastanka elektronskih molekulskih spektara potpuno je ekvivalentan
nehanizmu nastanka atomskih spektara. Prilikom dejstva molekula sa elektromagnetnim
zračenjem dolazi do promene ukupnog energetskog sastava molekula. Molekul
apsorbuje deo elektromagnetnog zračenja, a apsorbovana energija se koristi
za pobuđivanje elektrona: dolazi do prelaza elektrona iz osnovonog stanja
(stanje najniže energije) u jedno od pobuđenih stanja (stanje sa višom
energijom). Kako različiti elektroni određenog molekula poseduju različite
energije u osnovnom stanju, oni se pobuđuju zračenjem različitih talasnih
dužina.
Trakasti karakter elektronskih spektara možemo objasniti ako uzmemo u
obzir to, da uporedo sa promenom elektronskih stanja u molekulu usled
apsorpcije svetlosti, dolazi do permanetnog premeštanja atomskih jezgara,
koje dovodi do promene oscilatornih stanja molekula. Da bismo pojasnili
poslednju tvrdnju, objasnićemo kontinualni spektar dvoatomskoghomonuklearnog
molekula (na primer vodonika), ali najpre ćemo razmotriti oscilatorna
stanja za osnovno elektronsko stanje tog molekula. Kako je masa elektrona
veoma mala u poređenju sa masom atomskog jezgra, to obe čestice poseduju
znatno nejednake energije; iz tog razloga moguće je oscilatorna stanja
molekula posmatrati nezavisno od elektronskih stanja. Za svako elektronsko
stanje molekula, međusobno dejstvo elektrona i jezgra moguće je opisati
pomoću krive potencijalne energije, koja se izražava kao zavisnost potencijalne
energije jezgra ![]() od rastojanja između jezgara
od rastojanja između jezgara ![]() .
Ova kriva, prikazana na slici 1, pokazuje nam da se pri nekom ravnotežnom
rastojanju između jezgara
.
Ova kriva, prikazana na slici 1, pokazuje nam da se pri nekom ravnotežnom
rastojanju između jezgara ![]() ,
aktivne međuelektronske i iternuklearne, odbojne i privlačne sile uravnotežavaju,
a potencijalna energija takvog sistema dobija minimalnu vrednost.
,
aktivne međuelektronske i iternuklearne, odbojne i privlačne sile uravnotežavaju,
a potencijalna energija takvog sistema dobija minimalnu vrednost.
Ako se jezgra međusobno približavaju na rastojanju manjem od ![]() ,
potencijalna energija sistema oštro raste. Drugim rečima, da bismo držali
jezgra na rastojanju manjem od ravnotežnog potrebno je dovoditi energiju
sistemu. Ako se jezgra udaljavaju jedno od drugog, energija sistema u
početku raste, a zatim se postepeno približava maksimalnoj vrednosti,
na kojoj je međusobno dejstvo između elektrona i jezgara već toliko slabo,
da dolazi do disocijacije molekula na zasebne atome.
,
potencijalna energija sistema oštro raste. Drugim rečima, da bismo držali
jezgra na rastojanju manjem od ravnotežnog potrebno je dovoditi energiju
sistemu. Ako se jezgra udaljavaju jedno od drugog, energija sistema u
početku raste, a zatim se postepeno približava maksimalnoj vrednosti,
na kojoj je međusobno dejstvo između elektrona i jezgara već toliko slabo,
da dolazi do disocijacije molekula na zasebne atome.
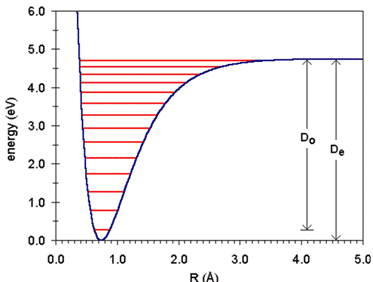
Slika 1. Kriva potencijalne energije dvoatomskog molekula
Očigledno je da je za potpunu disocijaciju molekula na atome potrebno utošiti određenu količinu energije. Kriva potencijalne energije pokazuje i da zajednička energija čvrstih molekula konstantna u nekom ograničenom intervalu međuatomskih rastojanja, na primer ![]() . Kako atomska jezgra osciluju oko ravnotežnih položaja, odgovarajući enrgetski nivoi nazivaju se oscilatornim energetskim nivoima. Teorijskim istraživanjima nađeno je da tim oscilatornim nivoima ne smemo pripisati proizvoljne iznose energije; svaki od njih određen je nekim oscilatornim kvantnim brojem
. Kako atomska jezgra osciluju oko ravnotežnih položaja, odgovarajući enrgetski nivoi nazivaju se oscilatornim energetskim nivoima. Teorijskim istraživanjima nađeno je da tim oscilatornim nivoima ne smemo pripisati proizvoljne iznose energije; svaki od njih određen je nekim oscilatornim kvantnim brojem ![]() , koji odgovara tom stanju. Na taj način, molekul u osnovnom stanju ima određen broj različitih oscilatornih energetskih nivoa. Energija svakog oscilatornog nivoa predstavlja zbir potencijalne i kinetičke energije. Za gotovo svaku elektronsku konfiguraciju moguće je dobiti krive potencijalne enrgije kao što je prikazano na slici 1; na taj način za svaki molekul postoji određen skup takvih krivi, kome odgovara jednak broj oscilatornih energetskih nivoa. Pri teorijskoj interpretaciji apsorpcionih spektara, važno je zapamtiti da ne postoji pravilo izbora za prelaze elktrona sa oscilatornog nivoa jedne elektronske konfiguracije na oscilatorni nivo druge elektronske konfiguracije; do elektronskih prelaza može doći između određenih oscilatornih nivoa osnovnog stanja i oscilatornih nivoa pobuđenog stanja (slika 2). Na taj način, za dati elektronski prelaz mi dobijamo celi niz oscilatorno–elektronskih prelaza, što nam omogućava da objasnimo trakasti karakter molekulskih apsorpcionih spektara. Različit intenzitet oscilatorno–elektronskih prelaza moguće je objasniti na Frank–Kodonovom principu. Po ovom principu, elektronski prelazi odigravaju se značajno brže nego oscilatorno kretanje jezgra. Shodno tome, u trenutku elektronskog prelaza (apsorpcije zračenja) relativni položaj i brzina jezgra ostaju praktično neizmenjeni. Saglasno Frank–Kodonovom principu, najverovatnijim prelazom između elektronskih nivoa, koji su prikazani na slici 2., smatra se prelaz sa osnovnog oscilatornog nivoa
, koji odgovara tom stanju. Na taj način, molekul u osnovnom stanju ima određen broj različitih oscilatornih energetskih nivoa. Energija svakog oscilatornog nivoa predstavlja zbir potencijalne i kinetičke energije. Za gotovo svaku elektronsku konfiguraciju moguće je dobiti krive potencijalne enrgije kao što je prikazano na slici 1; na taj način za svaki molekul postoji određen skup takvih krivi, kome odgovara jednak broj oscilatornih energetskih nivoa. Pri teorijskoj interpretaciji apsorpcionih spektara, važno je zapamtiti da ne postoji pravilo izbora za prelaze elktrona sa oscilatornog nivoa jedne elektronske konfiguracije na oscilatorni nivo druge elektronske konfiguracije; do elektronskih prelaza može doći između određenih oscilatornih nivoa osnovnog stanja i oscilatornih nivoa pobuđenog stanja (slika 2). Na taj način, za dati elektronski prelaz mi dobijamo celi niz oscilatorno–elektronskih prelaza, što nam omogućava da objasnimo trakasti karakter molekulskih apsorpcionih spektara. Različit intenzitet oscilatorno–elektronskih prelaza moguće je objasniti na Frank–Kodonovom principu. Po ovom principu, elektronski prelazi odigravaju se značajno brže nego oscilatorno kretanje jezgra. Shodno tome, u trenutku elektronskog prelaza (apsorpcije zračenja) relativni položaj i brzina jezgra ostaju praktično neizmenjeni. Saglasno Frank–Kodonovom principu, najverovatnijim prelazom između elektronskih nivoa, koji su prikazani na slici 2., smatra se prelaz sa osnovnog oscilatornog nivoa ![]() na pobuđeni oscilatorni nivo
na pobuđeni oscilatorni nivo ![]() . Drugi prelazi, na primer
. Drugi prelazi, na primer ![]() ,
, ![]() ,
, ![]() itd., su manje verovatni; u tim slučajevima ili se potencijalna i kinetička energija elektrona nakon prelaza razlikuju od početnih vrednosti, ili do oscilovanja dolazi sa viših oscilatornih nivoa osnovnog stanja, koje je na sobnoj temperaturi manje verovatno. Ove razlike u intenzitetu elektronskih prelaza odražavaju se na oblik traka elektronskog apsorpcionog spektra.
itd., su manje verovatni; u tim slučajevima ili se potencijalna i kinetička energija elektrona nakon prelaza razlikuju od početnih vrednosti, ili do oscilovanja dolazi sa viših oscilatornih nivoa osnovnog stanja, koje je na sobnoj temperaturi manje verovatno. Ove razlike u intenzitetu elektronskih prelaza odražavaju se na oblik traka elektronskog apsorpcionog spektra.
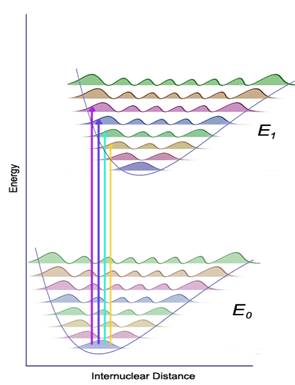
Slika 2. Kriva potencijalne enrgije koja ilustruje nastanak apsorpcionih traka
Klasifikacija elektronskih prelaza i elektronski spektri složenih molekula
Elektronski prelazi mogu se klasifikovati u skaldu sa svojstvima elektrona koji u prelazu učestvuju. Nosioci elektronskog molekulskog spektra mogu biti elektroni smešteni u ![]() ,
, ![]() i
i ![]() orbitalama. Prelaz se označava početnom i krajnjom orbitalom na koju elektron prelazi, tako da razlikujemo
orbitalama. Prelaz se označava početnom i krajnjom orbitalom na koju elektron prelazi, tako da razlikujemo ![]() ,
, ![]() ,
, ![]() i
i ![]() prelaze. Ova klasifikacija vredi u slučaju dvoatomskih molekula. Kod višeatomskih molekula orbitale nevezujućih elektrona mogu se kombinovati sa
prelaze. Ova klasifikacija vredi u slučaju dvoatomskih molekula. Kod višeatomskih molekula orbitale nevezujućih elektrona mogu se kombinovati sa ![]() orbitalama (na primer, nevezujuće orbitale elktrona azota sa
orbitalama (na primer, nevezujuće orbitale elktrona azota sa ![]() orbitalama aromatičnog prstena u aromatičnim aminima). Ovakve hibridne orbitale obeležavaju se sa
orbitalama aromatičnog prstena u aromatičnim aminima). Ovakve hibridne orbitale obeležavaju se sa ![]() . Dalje, ako molekul ne leži u jednoj ravni, vezujuća
. Dalje, ako molekul ne leži u jednoj ravni, vezujuća ![]() orbitala označava se sa
orbitala označava se sa ![]() , a antivezujuća sa
, a antivezujuća sa ![]() , jer pojam
, jer pojam ![]() orbitale važi za strogo linijske molekule. Prelazi se onda klasifikuju kao
orbitale važi za strogo linijske molekule. Prelazi se onda klasifikuju kao ![]() . Ukoliko se molekulu nalazi atom nekog
. Ukoliko se molekulu nalazi atom nekog ![]() –metala, nevezujući elektroni su elektroni
–metala, nevezujući elektroni su elektroni![]() orbitala. U tom slučaju mogu se javiti
orbitala. U tom slučaju mogu se javiti ![]() –
–![]() prelazi.Prelazu
prelazi.Prelazu ![]() odgovara najveća razlika u energijama pa se apsorpciona traka koja njemu odgovara nalazi u dalekoj UV oblasti. Prelazi
odgovara najveća razlika u energijama pa se apsorpciona traka koja njemu odgovara nalazi u dalekoj UV oblasti. Prelazi ![]() i
i ![]() sreću se u mnogim funkcionalnim grupama kao što su:
sreću se u mnogim funkcionalnim grupama kao što su: ![]() ,
, ![]() ,
, ![]() ,
, ![]() itd. Kriterijumi za klasifikaciju elektronskih apsorpcionih traka molekula su intenzitet trake, talasna dužina maksimuma apsorpcije i pomeranje trake prilikom promene rastvarača. Traka koja odgovara
itd. Kriterijumi za klasifikaciju elektronskih apsorpcionih traka molekula su intenzitet trake, talasna dužina maksimuma apsorpcije i pomeranje trake prilikom promene rastvarača. Traka koja odgovara ![]() prelazu obično se nalazi na dugotalasnoj strani spektra. Položaj
prelazu obično se nalazi na dugotalasnoj strani spektra. Položaj ![]() i
i ![]() traka približno se poklapaju, dok se trake koje odgovaraju
traka približno se poklapaju, dok se trake koje odgovaraju ![]() prelazima po pravilu nalaze u kratkotalasnoj strani spektra. Intenzitet
prelazima po pravilu nalaze u kratkotalasnoj strani spektra. Intenzitet ![]() trake nije veliki i obično je 10 do 100 puta manji od intenziteta
trake nije veliki i obično je 10 do 100 puta manji od intenziteta ![]() trake. Prilikom promene rastvarača od nepolarnih (parafinski ugljovodonici) ka polarnim (voda, alkoholi) maksimum apsorpcije
trake. Prilikom promene rastvarača od nepolarnih (parafinski ugljovodonici) ka polarnim (voda, alkoholi) maksimum apsorpcije ![]() pomera se ka kratkotalasnoj strani spektra (“plavo pomeranje”). Ovo pomeranje je uslovljeno snižavanjem energije osnovnog stanja i povećanjem energije pobuđenog stanja molekula u polarnim rastvaračima. Molekuli polarnih rastvarača imaju veliki dipolni momenat i stoga veoma dobro solvatizuju molekule rastvorene supstance.
pomera se ka kratkotalasnoj strani spektra (“plavo pomeranje”). Ovo pomeranje je uslovljeno snižavanjem energije osnovnog stanja i povećanjem energije pobuđenog stanja molekula u polarnim rastvaračima. Molekuli polarnih rastvarača imaju veliki dipolni momenat i stoga veoma dobro solvatizuju molekule rastvorene supstance.
Već je rečeno da se svaki apsorpcioni spektar molekula sastoji od niza apsorpcionih traka. Svaka od traka ima izgleda gausove krive i razlikuje se od ostalih svojim intenzitetom. Svaka apsorpciona traka karakteriše se talasnom dužinom ![]() (ili odgovarajućim talasnim brojem), na kojoj imamo maksimum apsorpcije i koja određuje položaj trake u spektru; molarnim koeficijentom apsorpcije
(ili odgovarajućim talasnim brojem), na kojoj imamo maksimum apsorpcije i koja određuje položaj trake u spektru; molarnim koeficijentom apsorpcije ![]() koji odgovara maksimumu apsorpcije i poluširinom trake
koji odgovara maksimumu apsorpcije i poluširinom trake ![]() , koja se meri u nanometrima. Poluširina trake je sa intenzitetom trake povezana sledećom formulom:
, koja se meri u nanometrima. Poluširina trake je sa intenzitetom trake povezana sledećom formulom:
![]()
Veličina poluširine trake uslovljena je karakterom i raspodelom oscilatornih nivoa, u okviru pobuđenog elektronskog stanja na koje se prelaz vrši. Ovi oscilatorni nivoi uslovljavaju finu strukturu elektronske apsorpcione trake.
Hromofore
Nosioci apsorpcije složenih molekula kao celine, u UV i vidljivoj oblasti (200–800 nm) obično su male atomske grupe u molekulu. Njihova apsorpcija može se razmatrati nezavisno od apsorpcije drugih grupa u molekulu. Ove grupe atoma nazivaju se hromofore. Apsorpcija hromofora potiče od ![]() ,
, ![]() ,
, ![]() ,
, ![]() –
–![]() i
i ![]() (electron transfer, prenos elektrona) elektronskih prelaza. Molekuli koji sadrže
(electron transfer, prenos elektrona) elektronskih prelaza. Molekuli koji sadrže ![]() i
i ![]() elektronske sisteme apsorbuju uglavnom u bliskoj UV, vidljivoj pa čak i bliskoj IC oblasti, dok molekuli koji sadrže samo
elektronske sisteme apsorbuju uglavnom u bliskoj UV, vidljivoj pa čak i bliskoj IC oblasti, dok molekuli koji sadrže samo ![]() elektronske sisteme po pravilu apsorbuju u dalekoj UV oblasti i nisu od interesa za analitičku hemiju. Svakoj hromofori u molekulu odgovara jedna ili više apsorpcionih traka, koje su karakteristične za tu hromoforu. Ukoliko molekul sadrži više hromofora onda će konačni izgled spektra u mnogome zavisiti od relativnog položaja hromofora u molekulu. Ako su hromofore direktno povezane rezultujući spektar razlikovaće se od spektara izolovanih molekula. Na primer, etilenska grupa pokazuje apsorpciju na
elektronske sisteme po pravilu apsorbuju u dalekoj UV oblasti i nisu od interesa za analitičku hemiju. Svakoj hromofori u molekulu odgovara jedna ili više apsorpcionih traka, koje su karakteristične za tu hromoforu. Ukoliko molekul sadrži više hromofora onda će konačni izgled spektra u mnogome zavisiti od relativnog položaja hromofora u molekulu. Ako su hromofore direktno povezane rezultujući spektar razlikovaće se od spektara izolovanih molekula. Na primer, etilenska grupa pokazuje apsorpciju na ![]() = 170 nm, međutim dve etilenske hromofore koje su direktno povezane apsorbuju na
= 170 nm, međutim dve etilenske hromofore koje su direktno povezane apsorbuju na ![]() = 225 nm. Ukoliko su dve hromofore konjugovane, onda obe hromofore zadržavaju svoju individualnost. Ukoliko se radi o
= 225 nm. Ukoliko su dve hromofore konjugovane, onda obe hromofore zadržavaju svoju individualnost. Ukoliko se radi o ![]() elektronskom sistemu, doći će do pomeranja maksimuma apsorpcije trake koje odgovaraju
elektronskom sistemu, doći će do pomeranja maksimuma apsorpcije trake koje odgovaraju ![]() i
i ![]() prelazima, ka višim talasnim dužinama. Ovakvo pomeranje naziva se crveno ili batohromno pomeranje. Istovremeno povećava se i intenzitet trake (hiperhromni efekat). Ukoliko su hromofore u složenom molekulu izolovane, rezultujući spektar je zbir apsorpcionih traka svake hromofore ponaosob. Na apsorpciju hromofora mogu uticati kovalentno zasićene grupe sa nedeljenim elektronskim parom (auksohrome), koje same ne apsorbuju u oblasti apsorpcije ali dovode do batohromnog pomeranja apsorpcije hromofore i do povećanja intenziteta apsorpcije. Tipične auksohrome su:
prelazima, ka višim talasnim dužinama. Ovakvo pomeranje naziva se crveno ili batohromno pomeranje. Istovremeno povećava se i intenzitet trake (hiperhromni efekat). Ukoliko su hromofore u složenom molekulu izolovane, rezultujući spektar je zbir apsorpcionih traka svake hromofore ponaosob. Na apsorpciju hromofora mogu uticati kovalentno zasićene grupe sa nedeljenim elektronskim parom (auksohrome), koje same ne apsorbuju u oblasti apsorpcije ali dovode do batohromnog pomeranja apsorpcije hromofore i do povećanja intenziteta apsorpcije. Tipične auksohrome su: ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() .
.
d–hromofore
Ovaj tip hromofore karakteriše se postojanjem jona metala koji ima nepopunjenu d–orbitalu, zajedno sa posebnim donor–atomima.Ovakvu hromoforu, koja se nalazi u kompleksnim jedinjenjima prelaznih metala, možemo označiti simbolom ![]() , gde je M–centralni jon, a X–donor atom. Pojava apsorpcionih traka ovih hromofornih grupa, uslovljena je prelazima koji su lokalizovani na jonu sa nepopunjenom d–orbitalom (d–d prelazi). Kako kod d–elektronskih hromofora do ovih prelaza dolazi između stanja istog pariteta, prelazi su zabranjeni po Laporte–ovom pravilu (Laporteovo pravilo: elektronski prelazi kod kojih dolazi do očuvanja simetrije ili asimetrije u odnosu na centar inverzije su zabranjeni), oni se ipak javljaju u spektru kao posledica oscilatorno–elektronskih interakcija (simetrijska svojstva koja ih striktno zabranjuju narušena su molekulskim vibracijama).Tada se molarni apsorpcioni koeficijenti kreću oko 1–200 lmol-1cm-1, a trake se karakterišu značajnom poluširinom trake–čak i do 350 nm. Prema tome, značajno širenje trake posledica je promene simetrije, spin–orbitalnih interakcija i Jan–Telerovog efekta. Do narušavanja simetrije uglavnom dolazi u slučaju sistema sa različitim donorskim atomima.
, gde je M–centralni jon, a X–donor atom. Pojava apsorpcionih traka ovih hromofornih grupa, uslovljena je prelazima koji su lokalizovani na jonu sa nepopunjenom d–orbitalom (d–d prelazi). Kako kod d–elektronskih hromofora do ovih prelaza dolazi između stanja istog pariteta, prelazi su zabranjeni po Laporte–ovom pravilu (Laporteovo pravilo: elektronski prelazi kod kojih dolazi do očuvanja simetrije ili asimetrije u odnosu na centar inverzije su zabranjeni), oni se ipak javljaju u spektru kao posledica oscilatorno–elektronskih interakcija (simetrijska svojstva koja ih striktno zabranjuju narušena su molekulskim vibracijama).Tada se molarni apsorpcioni koeficijenti kreću oko 1–200 lmol-1cm-1, a trake se karakterišu značajnom poluširinom trake–čak i do 350 nm. Prema tome, značajno širenje trake posledica je promene simetrije, spin–orbitalnih interakcija i Jan–Telerovog efekta. Do narušavanja simetrije uglavnom dolazi u slučaju sistema sa različitim donorskim atomima.
Osnovna ideja teorije kristalnog polja (ligandnog polja) zasniva se na simetriji sistema, tj. pretpostavka je da cepanje nivoa jona prelaznog metala, zavisi pre svega od elektrostatičke interakcije između ![]() –elektrona centralnog metalnog jona i atoma donora. Za većinu kompleksa sa koordinacionim brojem šest, pretpostavlja se oktaedarska simetrija. Ova simetrija pripisuje se i drugim komleksima, čak i u onim slučajevima kada neki od donor atoma imaju različite osobine, tako da je simetrija sistema u stvari niža. Promenu simetrije sistema možemo objasniti na primeru kompleksa kobalta(III) sa aminokiselinama. Na osnovu rezultata istraživanja magnetnih svojstava nađeno je da su ovi kompleksi dijamagnetični, tj. u osnovnom stanju d–elektroni su spareni. U ligandnom polju, usled elektrostatičkog odbijanja između liganada i d–orbitala centralnog metalnog jona, raste energija degenerisanih d–orbitala i nastaje pet pobuđenih, degenerisanih d–orbitala. Kada je prostorni raspored liganada oktaedarski, kao što je slučaj sa kompleksima kobalta, ligandno polje jače deluje na orbitale koje se nalaze duž x, y i z osa, tj. elektroni u
–elektrona centralnog metalnog jona i atoma donora. Za većinu kompleksa sa koordinacionim brojem šest, pretpostavlja se oktaedarska simetrija. Ova simetrija pripisuje se i drugim komleksima, čak i u onim slučajevima kada neki od donor atoma imaju različite osobine, tako da je simetrija sistema u stvari niža. Promenu simetrije sistema možemo objasniti na primeru kompleksa kobalta(III) sa aminokiselinama. Na osnovu rezultata istraživanja magnetnih svojstava nađeno je da su ovi kompleksi dijamagnetični, tj. u osnovnom stanju d–elektroni su spareni. U ligandnom polju, usled elektrostatičkog odbijanja između liganada i d–orbitala centralnog metalnog jona, raste energija degenerisanih d–orbitala i nastaje pet pobuđenih, degenerisanih d–orbitala. Kada je prostorni raspored liganada oktaedarski, kao što je slučaj sa kompleksima kobalta, ligandno polje jače deluje na orbitale koje se nalaze duž x, y i z osa, tj. elektroni u ![]() i
i ![]() orbitalama (
orbitalama (![]() simetrije) moraju imati veću energiju od elektrona u ostale tri orbitale:
simetrije) moraju imati veću energiju od elektrona u ostale tri orbitale: ![]() ,
, ![]() ,
, ![]() (
(![]() simetrije). Drugim rečima: d–orbitale pod uticajem oktaedarskog ligandnog polja cepaju se na dublet sa višom energijom (
simetrije). Drugim rečima: d–orbitale pod uticajem oktaedarskog ligandnog polja cepaju se na dublet sa višom energijom (![]() –dvostuko degenerisani par (e) simetričnih (g) orbitala) i triplet sa višom energijom (
–dvostuko degenerisani par (e) simetričnih (g) orbitala) i triplet sa višom energijom (![]() –trostruko degenerisani trio (t) simetričnih (g) orbitala) (slika 3).
–trostruko degenerisani trio (t) simetričnih (g) orbitala) (slika 3).
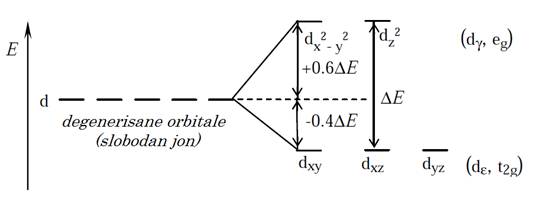
Slika 3. Cepanje orbitala u oktaedarskom ligandnom polju
Na osnovu aproksimacije sa teorijom ligandnog polja i okatedarskom simetrijom
sistema, dolazimo do toga da je elektronska konfiguracija u osnovnom stanju(![]() )(
)(![]() )
a osnovno stanje 1
)
a osnovno stanje 1![]() .Pri
prelazu elektrona na nivo sa većom energijom konfiguracija je (
.Pri
prelazu elektrona na nivo sa većom energijom konfiguracija je (![]() )(
)(![]() ),
a kao posledica ove konfiguracije javljaju se stanja 1
),
a kao posledica ove konfiguracije javljaju se stanja 1![]() i 1
i 1![]() .
Mogu se javiti i tripletna stanja, ali je intenzitet njihovih prelaza
isuviše mala. Tako, u apsorpcionim spektrima ovih kompleksa, javljaju
se dve trake, koje odgovaraju prelazima 1
.
Mogu se javiti i tripletna stanja, ali je intenzitet njihovih prelaza
isuviše mala. Tako, u apsorpcionim spektrima ovih kompleksa, javljaju
se dve trake, koje odgovaraju prelazima 1![]() 1
1![]() i 1
i 1![]() 1
1![]() .
Iako su kompleksi kobalta sa amino kiselinama manje simetrični od oktaedarskih,
primećuje se cepanje
.
Iako su kompleksi kobalta sa amino kiselinama manje simetrični od oktaedarskih,
primećuje se cepanje ![]() stanja. Ovo cepanje zavisi od konfiguracije donor atoma.
stanja. Ovo cepanje zavisi od konfiguracije donor atoma.
Već smo rekli da Jan–Telerov efekat dovodi do širenja apsorpcionih traka.
Prema Jan–Telerovoj teoremi do promene simetrije (krivljenja simetrije)
dolazi uglavnom kod kompleksa sa centralnim metalnim jonom koji ima nejednako
popunjene d–orbitale, da bi se uklonila degenerisanost osnovnog
elektronskog stanja (koja čini sistem veoma nestabilnim) daljim cepanjem
energetskih nivoa. Time se sistem stabilizuje, jer se smanjuje energija
centralnog metalnog jona. Videli smo da u oktaedarskom ligandnom polju
dolazi do cepanja orbitala na dva degenerisana energetska nivoa. Njima
odgovara jedna linija u apsorpcionom spektru, koja nastaje prelazom elektrona
iz![]() u
u ![]() nivo.
Kako prilikom krivljenja simetrije nastaje više spektralnih linija, očigledno
je da mora postojati više energetskih nivoa koji su nastali daljim cepanjem
degenerisanih nivoa
nivo.
Kako prilikom krivljenja simetrije nastaje više spektralnih linija, očigledno
je da mora postojati više energetskih nivoa koji su nastali daljim cepanjem
degenerisanih nivoa ![]() i
i ![]() .
Pored deljenja apsorpcione trake na više traka, usled Jan–Telerovog efekta
dolazi i do širenja traka, što je slučaj kod velikog broja nelinearnih
molekula. Istraživanjem d–d spektara nađeno je da, broj
d–d traka zavisi od broja d–elektrona i centralnog
jona, kao i od prostornog rasporeda donor atoma. Energija d–d
prelaza nije jednaka za sve komlekse datog jona, već zavisi od prirode
donor atoma.
.
Pored deljenja apsorpcione trake na više traka, usled Jan–Telerovog efekta
dolazi i do širenja traka, što je slučaj kod velikog broja nelinearnih
molekula. Istraživanjem d–d spektara nađeno je da, broj
d–d traka zavisi od broja d–elektrona i centralnog
jona, kao i od prostornog rasporeda donor atoma. Energija d–d
prelaza nije jednaka za sve komlekse datog jona, već zavisi od prirode
donor atoma.
Tabela 1. d–d prelazi kod kompleksa sa oktaedarskom simetrijom
Broj d–elektrona |
Broj prelaza (dozvoljeni po spinu) |
Osnovno stanje |
Pobuđeno stanje |
Beleška* |
|
1 |
3 |
2 |
1 |
|
1 |
5 |
5 |
2 |
|
1 |
5 |
5 |
1 |
|
1 |
2 |
2 |
2 |
|
2 |
3 |
3 |
3 |
|
3 |
4 |
4 |
|
|
2 |
4 |
4 |
3 |
|
3 |
3 |
3 |
|
d–π hromofore
Ovaj tip hromofore odgovara konfiguraciji koja uključuje i d–element i π–elektronski sistem molekula liganda. Prisustvo d–π hromofora detektuje se pojavom intenzivnih apsorpcionih traka, koje potiču ili od prelaza elektrona sa liganda na metal (![]() prelazi), ili sa metala na ligand (
prelazi), ili sa metala na ligand (![]() prelazi). Što je lakši prelaz elektrona sa jedne komponente kompleksa na drugu, to maksimum odgovarajuće apsorpcione trake ima veću talasnu dužinu u spektru. Kako kod ovih prelaza dolazi do prenosa elektrona sa jedne komponente kompleksa na drugu, oni se nazivaju prelazi sa prenosom naelektrisanja ili ET prelazi. Obično maksimumu apsorpcione trake odgovara veliki koeficijent apsorpcije; za prelaze koji su dozvoljeni po spinu obično iznosi od 102–104lmol-1cm-1. Budući da se ove intenzivne apsorpcione trake obično nalaze u oblasti gde ligand, sam po sebi uopšte ne apsorbuje, u cilju pronalaženja novih organskih reagenasa za fotometrijsko određivanje elemenata, bila je potrebna sinteza jedinjenja sa d–πhromofornim grupama. Ovo je moguće samo za one metale sa d–orbitalama, koji mogu postojati u dva oksidaciona stanja, koja se razlikuju jedno od drugog za jedan elektron, na primer: Ti(III)–Ti(IV); Co(II)–Co(III); Fe(II)–Fe(III); Cu(I)–Cu(II); Ru(II)–Ru(III).
prelazi). Što je lakši prelaz elektrona sa jedne komponente kompleksa na drugu, to maksimum odgovarajuće apsorpcione trake ima veću talasnu dužinu u spektru. Kako kod ovih prelaza dolazi do prenosa elektrona sa jedne komponente kompleksa na drugu, oni se nazivaju prelazi sa prenosom naelektrisanja ili ET prelazi. Obično maksimumu apsorpcione trake odgovara veliki koeficijent apsorpcije; za prelaze koji su dozvoljeni po spinu obično iznosi od 102–104lmol-1cm-1. Budući da se ove intenzivne apsorpcione trake obično nalaze u oblasti gde ligand, sam po sebi uopšte ne apsorbuje, u cilju pronalaženja novih organskih reagenasa za fotometrijsko određivanje elemenata, bila je potrebna sinteza jedinjenja sa d–πhromofornim grupama. Ovo je moguće samo za one metale sa d–orbitalama, koji mogu postojati u dva oksidaciona stanja, koja se razlikuju jedno od drugog za jedan elektron, na primer: Ti(III)–Ti(IV); Co(II)–Co(III); Fe(II)–Fe(III); Cu(I)–Cu(II); Ru(II)–Ru(III).
Kompleksi sa  prelazima
prelazima
Kako se ovi prelazi karakterišu prenosom d–elektrona sa metala,
potrebno je da metal bude u nižem oksidacionom stanju. Istovremeno mora
da postoji mogućnost da elektron zauzme slobodnu orbitalu liganda. Takvi
ligandi mogu se naći među organskim jedinjenjima sa jednom dvostrukom
vezom, ili kod jedinjenja sa nizom konjugovanih dvostrukih veza koje su
povezane sa atomom donora. Kao primer možemo navesti komplekse gvožđa
sa sledećim ligandima: 8–oksihinolin, 2–pikolonska kiselina (piridinkarboksilna),
2,2’–bipiridin, 1,10–fenantrolin. Odgovarajuće talasne dužine ovih prelaza
i molarni apsorpcioni koeficijenti dati su u tabeli 2.Apsorpcione trake
svih ovih prelaza nalaze se u vidljivoj oblasti i pripisuju se prelazu
jednog ![]() elektrona u slobodnu antivezujuću π–orbitalu liganda.
elektrona u slobodnu antivezujuću π–orbitalu liganda.
Tabela 2.*![]() prelazi za neke komplekse gvožđa (II)
prelazi za neke komplekse gvožđa (II)
Kompleks |
Talasna dužina prelaza |
εmax, l·mol-1cm-1 |
|
523 |
8,60·103 |
|
510 |
1,12·104 |
|
446 |
1,00·103 |
|
581 |
5,00·103 |
Zbog činjenice da uvođenje bilo kojeg supstituenta u π–elektronski sistem dovodi do promene relativnih vrednosti energije molekulskih orbitala, talasna dužina trake koja odgovara prenosu naelektrisanja, kod ovih liganada sa supstituentom se takođe menja. Kao primer mogu poslužiti kompleksi Fe(II) sa različitim derivatima 8–oksihinolina i 1,10–fenantrolina (tabela 3).
Tabela 3. Uticaj supstituenata na talasnu dužinu ![]() prelaza
prelaza
Metal |
Ligand |
Supstituent |
Talasna dužina prelaza |
Fe (II) |
8–oksihinolin |
– |
581 |
|
|
5–metil |
595 |
|
|
5–fluoro |
605 |
|
|
5–cijano |
600 |
|
|
5–formil |
608 |
|
1,10–fenantrolin |
– |
510 |
|
|
4,7–bifenil |
533 |
|
|
4–oksi |
544 |
|
|
3–etoksikarbonil–4–oksi |
561 |
|
|
8–etoksikarbonil–7–oksi–4–metil–2–aza |
605 |
Razne studije utvrdile su, takođe, da intenzitet traka koje potiču od prenosa naelektrisanja zavisi od simetrije d–π hromofornih grupa. U slučaju da hromoforna grupa poseduje centar simetrije, molarni apsorpcioni koeficijent iznosi oko 102lmol-1cm-1, dok hromoforna grupa bez centra simetrije ima molarni apsorpcioni koeficijent od 103–104 lmol-1cm-1. Kod molekula sa centrom simetrije važi Laporteovo pravilo, pa intenzitet ovih prelaza nije veliki. Kod molekula bez centra simetrije Laporteovo pravilo ne važi pa je intenzitet ovih prelaza znatno veliki. U tabeli 2, svi prikazani kompleksi su bez centra simetrije. U tabeli 4, prikazani su kompleksi gvožđa sa centrosimetričnim hromofornim grupama.
Tabela 4.*![]() prelazi za neke komplekse gvožđa sa centrosimetričnim d–π hromofornim grupama
prelazi za neke komplekse gvožđa sa centrosimetričnim d–π hromofornim grupama
Kompleks |
λmax, nm |
εmax, l·mol-1cm-1 |
|
520 |
400 |
|
510 |
500 |
|
475 |
270 |
|
440 |
300 |
Kompleksi sa  prelazima
prelazima
Ovo je drugi tip prelaza sa prenosom naelektrisanja, tj. prelazi kod kojeg elektron prelazi sa liganda na metal, a javlja se u onim kompleksima gde se metal koji ima d–elektrone, lako može vratiti u niže oksidaciono stanje kao rezultat primanja elektrona. Istovremeno, potrebno je da molekul liganda ima π–elektronski sistem, vezan za kiselinsku grupu; ova grupa interaguje sa jonom metala i omogućava nevezivnim elektronima da se slobodno prenose na jone metala. Te kiselinske grupe su: OH, SH, NH. Nakon deprotonovanja nevezivni elektron smešta se u nevezivne orbitale π–elektronskog sistema, a prilikom obrazovanja kompleksa prenosi se u praznu d–orbitalu jona metala. Primeri ovakvih kompleksa sa Fe(III) i Co(III) prikazani su u tabeli 5.
Tabela 5.**![]() prelazi za neke komplekse Fe(II) i kobalta(II)
prelazi za neke komplekse Fe(II) i kobalta(II)
Kompleks |
Talasna dužina |
εmax, l·mol-1cm-1 |
|
581 |
4,00·103 |
|
425 |
6,30·103 |
|
480 |
6,30·103 |
|
610 |
3,60·103 |
|
425 |
2,35·104 |
|
640 |
1,70·104 |
Tabela 6. Uticaj supstituenata na talasnu dužinu ![]() prelaza
prelaza
Metal |
Ligand |
Supstituent |
Talasna dužina |
Fe(III) |
8–oksihinolin |
– |
580 |
|
|
5–metil |
607 |
|
|
5–fluoro |
592 |
|
|
5–karboksietil |
583 |
|
|
5–cijano |
587 |
|
|
5–formil |
595 |
Kao i u slučaju prenosa elektrona sa metala na ligand, i ovde se talasna dužina trake koja nastaje usled prenosa elektrona menja sa uvođenjem supstituenata (tabela 6).
π hromofore
Ove hromofore predstavljaju sisteme sa jednom ili nekoliko dvostrukih veza. Primer prostih hromofora ovog tipa su sledeće funkcionalne grupe: etilenska, karbonilna, nitrozo, tiol. Hromoforne grupe sa većim brojem dvostrukih veza su fenil i piridinska grupa. Pri interpretaciji apsorpcionih spektara važno je zapamtiti, da dve hromoforske grupe, razdvojene metilenskom grupom, skoro u celosti zadržavaju svoje individualne osobine; nataj način spektar sadrži veći ili manji broj traka, koje odgovaraju zasebnim hromoforama. Jasno je da, što je veći broj metilenskih grupa između hromofora, biće slabija interakcija između odvojenih hromofora. Ukoliko su π–hromofore direktno povezane jedna sa drugom, odsustvuje konjugacija, a uočen spektar se razlikuje od spektra individualnih hromofori. Ovo uparivanje može biti narušeno samo sternim smetnjama.
Kompleksna jedinjenja, boja kompleksa i značaj u analitičkoj hemiji
Kompleksnajedinjenja imaju ogroman analitički značaj: primenjuju se zadokazivanje,
određivanje, razdvajanje, maskiranje i demaskiranje analita. Boja neke
supstance izazvana je apsorpcijom svetlosti, pa ako prozirna supstanca
propušta odgovarajuću boju, a neprozirna odbija deo vidljivog dela spektra
a drugi deo apsorbuje, boja supstance je komplementarnaapsorbovanoj. To
znači da ako supstanca propušta sve delove vidljivog spektra (400–700
nm) ona je bezbojna aako sve apsorbuje onda je crna. Veliki deo analitičkih
primena kompleksnih jedinjenja temelji se upravo načinjenici da su oni
vrlo često karakteristično i intenzivno obojeni (neki primeridati su u
tabeli 7).Dakle i boja kompleksa uzrokovana je apsorpcijom dela vidljivog
spektra a vidi se boja komplementarnaapsorbovanoj, npr., zbog apsorpcije
plave boje vidi se žuta boja. Supstanca je, npr., žute boje ako apsorbuje
deovidljivog spektra od 400–500 nm i 600–700 nm a propušta samo fotone
talasnih dužina 500–600 nm. Supstance koje su sastavljene od jona tj.
molekula stabilne elektronske konfiguracije plemenitog gasa, većinom subezbojne
jer je potrebna velikaenergija za pobuđivanje stabilne elektronske konfiguracije.Supstance
koje sadrže jone prelaznih elemenata s nepopunjenim d i forbitalama
su većinom obojene. To naročito važi za joneprelaznih elemenata koji sadrže
nesparene d–elektrone: Cu2+ (1 nesparen elektron), Ni2+ (2 nesparenaelektrona),
Cr3+ i Co2+ (3 nesparena elektrona), Mn3+ i Fe2+ (4 nesparena elektrona),
Mn2+ i Fe3+ (5nesparenih elektrona). Joni koji ne sadrže nesparene elektrone
(npr., Cu+, Zn2+, Cd2+) su bezbojni.
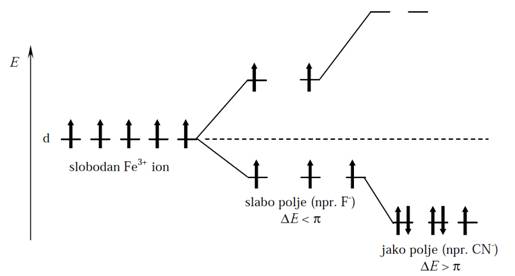
Slika 4. Cepanje energetskih nivoa d–orbitala
Fe3+ jona u slabom i jakom ligandnom polju
Boja hemijskih jedinjenja koja sadrže prelazni metal uzrokovana je tendencijom
tih jona da grade kompleksne jone. Videli smo, da prema teoriji ligandng
polja električno polje koordinisanih liganada oko centralnog jona izaziva
cepanje enrgetskih nivoa d–orbitala, te nastaju kod oktaedarske
koordinacije ![]() orbitale niže energije i
orbitale niže energije i ![]() orbitale više energije. Razlika u energiji između ovih orbitala Δ zavisi
od jačine ligandnog polja. Prema tome, elektroni
orbitale više energije. Razlika u energiji između ovih orbitala Δ zavisi
od jačine ligandnog polja. Prema tome, elektroni ![]() orbitale mogu apsorpcijom svetlosti preći u
orbitale mogu apsorpcijom svetlosti preći u ![]() orbitale (d–d prelaz). Isto razmatranje važi i za kvadratno
i tetraedarsko ligandno polje. Apsorbovana enrgija mora biti jednaka energiji
cepanja Δ. Npr., cepanje energetskih nivoad–orbitala Fe3+jona
u slabom i jakom ligandnom polju (π je energijasparivanja elektrona) može
se prikazati kao na slici 4.
orbitale (d–d prelaz). Isto razmatranje važi i za kvadratno
i tetraedarsko ligandno polje. Apsorbovana enrgija mora biti jednaka energiji
cepanja Δ. Npr., cepanje energetskih nivoad–orbitala Fe3+jona
u slabom i jakom ligandnom polju (π je energijasparivanja elektrona) može
se prikazati kao na slici 4.
Što je veća energija cepanja (jako ligandno polje), to se apsorpcija svetla pomera više prema ljubičastom tj. UV spektralnom području. Obratno, uz manju energiju cepanja (slabo ligandno polje) apsorpcija se pomiče prema crvenom i infracrvenom spektralnompodručju. Prema tome sa porastom jačine ligandnog polja apsorpcija svetlosti se pomera prema kraćim talasnim dužinama i obratno, što pokazuje spektrohemijski niz liganada:
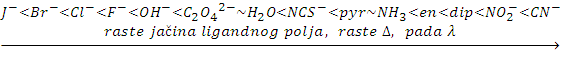
Tabela 7. Uticaj liganda na boju kompleksa
Kompleksni jon |
Apsorpcija u spektralnom području |
Boja |
|
|
ružičast |
|
|
crvenkast |
|
zelenom |
svetlo ljubičast |
|
zelenom |
tamno ljubičast |
|
žutom |
plav |
|
žuto–zelenom |
azurno plav |
|
UV |
bezbojan |
|
IR |
svetlo zelen |
|
plavom |
žut |
|
UV |
bezbojan |
|
|
smeđe–žut |
|
crvenom |
zelen |
|
zelenom |
plav |
|
|
bledo ružičast |
|
zelenom |
tamno ljubičast |
Kompleksi sa organskim bidentatnim i polidentatnim ligandima
Metalni joni stvaraju komplekse s organskim molekulima, koji danas zauzimajuvrlo važno mesto u raznim područjima hemije. Kao organski ligandi dolazemolekuli i joni koji sadrže O, S, N, P tako vezane da svojim elektronskim parom mogustvoriti kovalentnu vezu sa centralnim atomom. Opšte su poznati sledeći organski ligandi:
- joni: C2O42-, C4H4O62-, H2N-CH2-COO-(glicinat), joni aminopolikarbonskihkiselina, npr., iminodiacetatne kiseline, nitrilotriacetatne kiseline, etilendiamintetrasirćetne kiseline, itd.
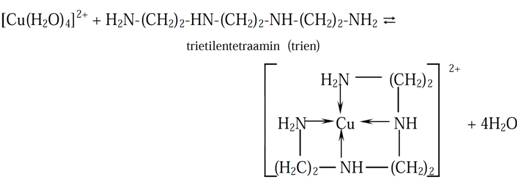
- molekuli:etilendiamin, trietilentetraamin (trien), 1,10–fenantrolin, a,a'–dipiridil, itd.
Ligandi sadva ili više donorskih atoma mogu se vezati sadve i više kovalentnih veza ina taj način sasvim obuhvatiti središnji atom. G. T. Morgan i H. D. K. Drew nazvali suova kompleksnajedinjenjahelatima.
Helati, helatni i entropijski efekat
Helati su kompleksi nastali s polidentatnim ligandima u kojima je više
od jednogdonorskog atoma vezano na isti središnji atom. Prstenaste su
strukture i odlikuju sevisokom stabilnošću zbog čega imaju veliku analitičku
primenu. Najstabilniji supetočlani ili šestočlani prstenovi: naponu prstenovima
je tada minimalan, a akometalni jon i ligand grade više ovakvih prstenova
stabilnost helata se povećava.Stabilnost helata je uopšteno veća od stabilnosti
ostalih kompleksa za nekoliko redova veličine, što je posledica helatnog
i entropijskog efekta.Mogu nastati bezbojni ili obojeni rastvornihelati
ili različito obojeni talozi. Helatimogu biti nenaelektrisani ili mogu
nositi pozitivno ili negativno naelektrisanje. Naelektrisani helati, npr.
pozitivno naelektrisanihelati gvožđa s 1,10–fenantrolinom i negativno
naelektrisani EDTA helati, kao i oni koji sadrže hidrofilne grupe kao
što je sulfonska grupa -SO3su rastvorljivi uvodi. Nenaelektrisani helati
koji ne sadrže hidrofilne grupe su nerastvorljivi u vodi, npr., Ni–dimetilglioksimat.Ako
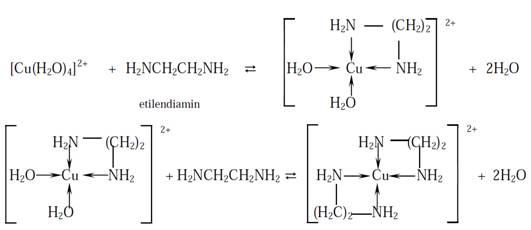
za primer uzmemo bidentatni ligand, onda reakcija kompleksiranja teče
u 2 stupnja:
Na taj način od jedne četvorostepene reakcije dobili smo dvostepenu, a
stabilnost nastalog kompleksa znatno je veća od stabilnosti tetraaminskog
kompleksa.Ako bi sada primenili ligand s četiri slobodna elektronska para
(tetradentatni)reakcija bi se odvijala u jednom stupnju, nastao bi 1:1
helatni kompleks velike konstantestabilnost:
Nestabilnost kompleksa govori uopšteno o istiskivanju liganda iz koordinacionesfere molekulama rastvarača. Zbog toga, ako jedan molekulrastvarača i uđe u sferukoordinacije, polidentatni ligand ostaje svojim drugim delom u sferi što pridonosistabilnosti kompleksa. Ovako se tumači velika stabilnost helata. Osim toga stabilnost helatnog kompleksa uzrokovana je potpunijom dehidratacijom centralnog iona, jer jedanpolidentatni ligand istisne više molekula rastvarača. Na primer:
![]()
![]()
![]()
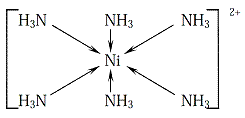
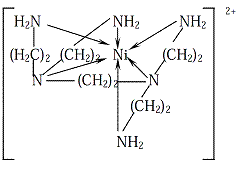
Slika 5. Kompleksi nikla sa monodentatnim
(amonijak) i polidentatnim (pentaetilenheksaamin) ligandom (s leva na
desno)
Stabilnost kompleksa zavisi od razlike u energiji između reaktanata tj.
centralnog metalnog atoma i liganda te produkta (nastalog kompleksa).
Što je nastali kompleksstabilniji to ima niži sadržaj energije. Monodentatni
ligandi vezuju se za centralni metalni atom u sukcesivnim koracima, pri
čemu svaki korak uključuje približno jednakupromenu entalpije za razliku
od polidentatnih liganada koji se inkorporiraju u jednomkoraku uključujući
veću promenu entalpije. Zato je helat stabilniji od sličnogkompleksa sastavljenog
od monodentatnih liganada.
Uzmimo na primer Ni(II)–heksaamino kompleks i Ni(II)–penten kompleks (nastaje sa polidentatnim ligandom pentaetilenheksaaminom) (slika 5). U prvom kompleksu uključeni su pojedinačni molekuli NH3, dok su u drugom aminogrupe vezane preko –CH2–CH2– lanaca. Razlika u stabilnosti može se objasniti time štose jedan izolovani ligand može lako ukloniti npr., u koliziji s molekulom vode ili zbogtermičkog kretanja. U drugom slučaju, potrebno je istovremeno maknuti 6 atoma azota, povezanih ugljovodoničnim lancima u pentenu. Dakle, svaki koordinativno vezani azot teže je istisnuti iz već nastalog kompleksa nego NH3, jer će još uvek drugi ostativezan; ako jedna veza pukne polidentatni ligand se drži drugom pa je stabilnostpovećana. Numerička procena helatnog efekta dobija se iz razlike u konstantamastabilnosti kompleksa istog metala sa polidentatnim i monodentatnim ligandima, sa istimdonorskim grupama. Npr., Ni(II)–heksaamino kompleks ima![]() od 8,90, dok Ni(II)–penten kompleks ima
od 8,90, dok Ni(II)–penten kompleks ima![]() od 19,3. Dalje, kumulativna konstanta stabilnosti Cu(II)–tetraamino kompleksaiznosi
od 19,3. Dalje, kumulativna konstanta stabilnosti Cu(II)–tetraamino kompleksaiznosi ![]() =12,59 (
=12,59 (![]() = 4,13;
= 4,13;![]() =3,48;
=3,48; ![]() =2,87;
=2,87;![]() =2,11), dok u kompleksu Cu–etilendiamin ona iznosi
=2,11), dok u kompleksu Cu–etilendiamin ona iznosi![]() =20,03 (
=20,03 (![]() =10,72;
=10,72;![]() =9,31), a u Cu–trienu iznosi
=9,31), a u Cu–trienu iznosi ![]() =20,5. StabilnostCu–triena gotovo je 108 puta veća od stabilnosti kompleksa Cu(II)–tetraamino kompleksa. Povećana stabilnost helata tumači se i time da, ako jedan azot iz bidentatnog ilitetradentatnog liganda reaguje sa metalnim jonom drugi je u neposrednoj blizini i vezametal–N se uspostavlja brže i jednostavnije nego pri ulasku drugog molekulaNH3, koji semora približiti s neke udaljenosti i vezati. Kao što je već rečeno pri helataciji spolidentatnim ligandom dolazi i do potpune dehidratacije centralnog metalnog iona ujednom koraku.Formiranje kompleksa metalnog jona sa polidentatnim ligandom može se opisati na sledeći način:
=20,5. StabilnostCu–triena gotovo je 108 puta veća od stabilnosti kompleksa Cu(II)–tetraamino kompleksa. Povećana stabilnost helata tumači se i time da, ako jedan azot iz bidentatnog ilitetradentatnog liganda reaguje sa metalnim jonom drugi je u neposrednoj blizini i vezametal–N se uspostavlja brže i jednostavnije nego pri ulasku drugog molekulaNH3, koji semora približiti s neke udaljenosti i vezati. Kao što je već rečeno pri helataciji spolidentatnim ligandom dolazi i do potpune dehidratacije centralnog metalnog iona ujednom koraku.Formiranje kompleksa metalnog jona sa polidentatnim ligandom može se opisati na sledeći način:
![]()
Nastajanje helata nastoji povećati nered sistema; dakle entropija je povećana (entropijski efekt). Kako ovo dovodi do padaentalpije to doprinosi povećanoj stabilnosti helata.Helati nastaju između metalnog jona i liganda koji je organski molekul, a možeposedovati dve vrste grupa:
- grupe kiselog karaktera koje sadrže vodonik koji se može zameniti s metalom uznastajanje kovalentne veze (–COOH, –OH, –SO3H, itd.);
- grupe baznog karaktera koje sadrže slobodan elektronski par sposoban da stvaradonorsku vezu (amino –NH2, imino =NH, tercijarni azot =N–, oksim =NOH,karbonilna C=O, itd.)
Ligandi koji sadrže i kisele i baznegrupe, mogu graditi električno neutralne helate, npr., dimetilglioksim koji s Ni2+ gradi kompleks s petočlanim prstenovima, dodatno stabilizovan vodoničnim mostovima kao ružičasto–crveni voluminozni talog. Najjednostavniji organski ligand je glicin (aminosirćetna kiselina), gde vodonik iz karboksilne grupe odlazi i između metalnog jona i kiseonika ostvaruje se kovalentnaveza, a azot iz –NH2 grupe daje svoj slobodni elektronski par.
Ligandi s kiselim grupama daju električno neutralne ili naelektrisanehelate, katjoneili anjone. Helatni anjoni nastaju onda kada u organskom ligandu postoji veći brojkiselih grupa nego što odgovara pozitivnom naelektrisanju metalnog jona. Takvi ligandi mogubiti različiti fenoli; ako se uz fenolnugrupu u orto položaju nalazi još neka kiselagrupa ona pojačava boju i daje veću stabilnost kompleksa. Na primer, tiron, salicilnakiselina i rastvorljiva 5–sulfosalicilna kiselina reaguju sa Fe3+, dajući rastvorljive komplekse čijaboja zavisi od kiselosti sredine, pa mogu služiti i kao analitički reagensi i kaometalohromni indikatori:
Ligand R2- |
|
|
|
|
pH 1–3 |
pH 3–5 |
alkalno |
Salicilat |
crveno–ljubičast |
rumeno–crven |
narandžasto–žut |
Fenolat |
plavo–zelen |
plavo–ljubičast |
narandžasto–crven |
Ljubičasto do crveno–ljubičasto obojenje u slabo kiseloj sredini odgovara kompleksu salicilne kiseline s Fe3+. Ovakav kompleks ne daje Fe2+ kojeg prethodno treba oksidovati, npr., sa peroksodisulfatom. Reakciju Fe3+ moguće je maskirati fluorid jonom. Na ovoj sereakciji temelji spektrometrijsko određivanje salicilne kiseline kao onečišćenja uacetilsalicilnoj kiselini i njenim pripravcima, dokazivanje salicilne i sulfosalicilne kiseline, kao i spektrometrijsko određivanja gvožđa u pHintervalu od 2,6 do 2,8. Reakcijaje selektivna jer smeta samo Ti4+. Izvedena kao reakcija u kapi* ova reakcija imavrednost pD od 5,5. Dokazivanje gvožđa moguće je izvesti i reakcijom u kapi nafilter papiru impregniranom salicilnom kiselinom. Primenom 5–sulfosalicilne kiseline moguće je dokazati 100 ng gvožđa reakcijom u kapi, odnosno 40 ng gvožđa reakcijom u kapi na smoli ili ga odrediti spektrometrijski.
Difenol tiron (1,2–dihidroksibenzen–3,5–disulfonska kiselina ili katehol–3,5–disulfonska kiselina), daje crveni, stabilni anjonski komplekssa Fe(III) u alkalnoj sredini. Reakcijom u kapi postiže se granica identifikacije od 50 ng (pD = 6), a reakcijom u kapina smoli granica identifikacije od 8 ng gvožđa. Ova reakcija je i osnova spektrometrijskog određivanja gvožđa.
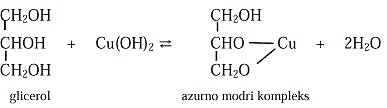
Sledeću reakciju daju jedinjenja sa najmanje dvehidroksilne grupe, a služi za dokazivanje glicerola:
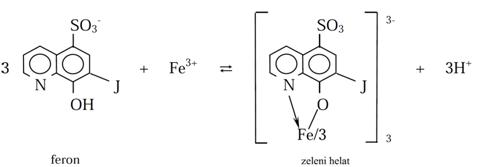
Analitički je vrlo značajan i kompleks Fe3+ s feronom (8–hidroksihinolin–7–jodo–5–sulfonska kiselina):
Ovom reakcijom sa Fe3+ (Fe2+ je ne daje) nastaje negativno naelektrisani kompleks zbog dobro disosovanih kiselih sulfonskih grupa. Ako se reakcija izvodi kao reakcija u kapi na Feiglovoj pločici postiže se granica identifikacije od 0,5 mg Fe3+, a ako se izvodi reakcijom u kapi na smoli LI se spušta čak na 2 ng Fe3+. Visoku selektivnost reakcije s Fe3+ može se postići, odnosno izbeći smetnja od Al3+, Zn2+ i PO43-ekstrakcijom zelenog helata u obliku jonskog asocijata sa tetrabutil amonijum–acetatom u izoamil alkoholu.Hidroksamske kiseline su biološki važna jedinjenja ali i važni analitički reagensi. Tosu organski ligandi koji reaguju s nizom metalnih jona, dajući karakteristično obojene istabilne helate koji su osnova postupaka dokazivanja ili određivanja.
Hidroksamskekiseline se odlikuju amidnom strukturom i slabo kiselim karakterom (pK oko 9). Npr., cimethidroksamska kiselina je monohidroksamska kiselina i bidentatni ligand,koja s Fe3+ u kiselojsredini daje crveni do ljubičasti neutralni kompleks, a koji jetemelj dokazivanja gvožđa reakcijom u kapi ili volumetrijskog određivanja:
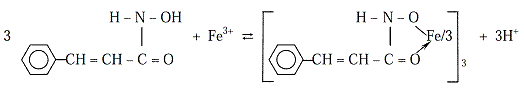
Trihidroksamska kiselina (desferioksamin B), komercijalno je poznat kao farmaceutski preparat, a služi i kao osjetljivi analitički reagens za dokazivanje i određivanje jona gvožđa i vanadijuma. Reakcijom u kapi moguće je dokazati 29 ng a reakcijom u kapi na smoli samo 0,3 ng gvožđa.
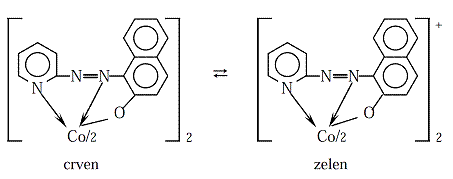
PAN (1–(2–piridilazo)–2–naftol) i PAR(4–(2–piridilazo)rezorcinol) suheterociklične azo boje koje imaju ulogu tridentatnih liganada, te su važni analitičkireagensi i metalohromni indikatori. Oni služe za dokazivanje mnogih metalnih jona s kojima grade u vodi nerastvorne, obojene komplekse. Ovakve reakcije mogu poslužiti i za opšta ispitivanja na teške metale kao onečišćenje u raznim pripravcima, npr., lekovima. Uvođenjem ovih reagenasa u matricu jonskog izmjenjivača dobija se helatirajući jonski izmjenjivač koji omogućuje dokazivanje nanogramskih masa metalnih jona. Reakcije oba reagenasa sa metalnim jonima temelj su i postupaka spektrometrijskih određivanja.Joni kobalta reaguju s PAN–om dajućioktaedarske komplekse. Co2+ najpre reaguje s PAN–om dajući crveni neutralni helat [Co(PAN)2], koji se već s atmosferskim kiseonikom, ili H2O2–om u vodenom rastvoru oksidujeu stabilniji zeleni kompleks [Co(PAN)2]+.
Ovaj kompleks je vrlo stabilan čak i u jako kiselomrastvoru. Prema teoriji ligandnog poljastabilizovana je oktaedarska konfiguracija trovalentnog kobalta. Ipak, ako se prePAN–a u reakcionu smešu doda EDTA, onemogućeno je nastajanje kompleksa [Co(PAN)2]+. Ovaj kompleks je zeleni talog koji se može rastvarati i ekstrahovati organskimrastvaračima, npr. CHCl3, u obliku mešovitog kompleksa koji nastaje u prisustvuanjonskog liganda (CH3COO-, Cl-, ClO4-),pa je temelj spektrometrijskogodređivanja Co2+jona. Isti sistem može poslužiti i za odvajanjejona kobalta od drugihmetalnih jona. U slabo kiseloj sredini (pH 4–5) Co2+ gradi tamno smeđe–crveni kompleks, Ni2+gradi crveni a Fe3+ crveno–smeđi kompleks. Zakišeljavanjem s HCl do pH ≤1rastvor sa gvožđem i niklom oboji se žuto, verovatno zbog rastvaranja odgovarajućihkompleksa. Istovremeno, [Co(PAN)2] se u jako kiselojsredini u prisustvu vode, oksidujeu [Co(PAN)2]+, pa se može rastvoriti i koncentrovati u CHCl3 kojise obojitamno zelenom bojom. Na ovaj način moguće je vrlo osetljivo i selektivno dokazivanjeCo2+ u prisustvu viška Ni2+i Fe3+jona.Zbog elektronske konfiguracije PAR–a u njegovomkompleksu s kobaltom, trovalentni oblik kobalta je još dodatno stabilizovan pa je onstabilan i u prisustvu askorbinske kiseline kao reduktora.
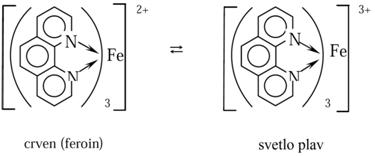
Ako organski molekul sadrži najmanje dve bazne grupe u pogodnom položaju, a ne sadrži kisele grupe reakcijom s metalnim jonom mogu nastati helatni kajoni kakvi su, npr., helati bakra s etilendiaminom i trietilentetraaminom (trienom). Analitički su važni i stabilni obojeni helatni katjoni gvožđa s 1,10–fenantrolinom:
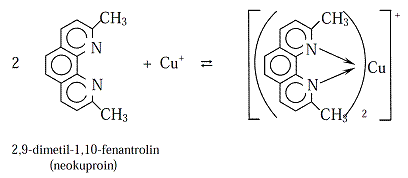
Kompleks Fe2+ s 1,10–fenantrolinom i s njegovim 5–nitro derivatom važni su redoksindikatori. 1,10–fenantrolin reaguje i s Cu+.Uvođenje supstituenata u molekul liganda utiče na stabilnost kompleksa zbogpromene gustine elektrona ili zbog sternih faktora. Npr., 1,10–fenantrolin daje s Fe2+stabilan crveno obojeni kompleks koji zbog svojih konjugiranih π-veza deluje kaosnažan π–akceptor. Uvođenjem –NO2, –SO3H, itd., raste stabilnost kompleksa. Ako seuvedu –CH3grupe u položaje 2 i 9 nastaju sterne smetnje i ne nastaje kompleks sagvožđem. Istovremeno sa Cu+čiji je koordinacioni broj 4 daje stabilan i obojenkompleks [CuL2]+ jer u tetraedarskom kompleksu–CH3grupe jedna drugoj nesmetaju.
Analitički je važna i reakcija nastajanja žutog helatnog katjona bizmuta stioureom:
Bi3+ + n SC(NH2)2![]() {Bi[SC(NH2)2]n}3+
{Bi[SC(NH2)2]n}3+
Ova selektivna reakcija dokazivanja bizmuta izvodi se kao reakciju u kapi
na filterpapiru ili na granulama jonskog izmenjivača.
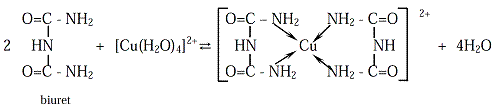
Alkalnirastvor biureta oboji se dodatkom bakar–sulfata ljubičasto-ružičasto
zbog nastajanja koordinacionog jedinjenja sa Cu2+jonom u kojem su amino
grupezamenile četiri molekule vode iz hidratisanog jona bakra:
Baza uklanja s amino grupa dva protona dajući najpre nerastvorljiv neutralni
kompleks,a zatim još dva protona, dajući so koja se rastvara u vodi. Biuretska
reakcija služiza dokazivanje i spektrometrijskom određivanju uree, ali
je daju i proteini i peptidi, jerpeptidna veza u proteinima može dovesti
do nastajanja stabilnog kompleksa s bakrom u kojem nastaju petočlani prstenovi.
Specifičnu reakciju jona dvovalentnog gvožđa s bidentatnim ligandom a,a'–dipiridilom
možemo iskoristiti i zadokazivanje Fe3+nakon njegove redukcije s tioglikolnom
kiselinom; reakcijom u kapimoguće je dokazati 30 ng a reakcijom u kapi
na smoli 5 ng gvožđa.U amonijačnojsredini Fe2+daje s tioglikolnom kiselinom
crveno–ljubičastikompleks, [Fe(SCH2COO)2]2-, na temelju kojeg je moguće
izvesti osjetljivodokazivanje ili spektrometrijsko određivanje ukupnog
gvožđa.
Jednu od najvažnijih grupahelatnih kompleksa, pretežno anjona, činekompleksi
metalnih jona s aminopolikarbonskim kiselinama, kompleksonima, koje je
uanalitičku praksu uveo švajcarskihemičar G. Schwarzenbach. Najznačajniji
predstavnikte grupe je etilendiamin tetrasirćetna kiselina, a najjednostavniji
jeiminodisirćetna kiselina. Najčešće primenjivani reagens za maskiranje
jona je EDTA, koja stvara bezbojne helate. Ona ima šest funkcionalnih
grupa, to je jonski ligand, reaguje sa metalnim jonima u odnosu 1:1 i
koristi se u kompleksometriji.EDTA ili H4Y jeste tetraprotonska kiselina
pa se može koristiti kao primerpolidentatnog liganda na koji utiče pH.
Luminiscencija organskih reagenasa i njihovih kompleksa
Luminiscencija predstavlja emisiju elektromagnetnog zračenja supstance koja se nalazi u pobuđenom stanju kao rezultat apsorpcije zračenja. Prilikom emisije luminiscentnog zračenja supstanca se vraća u osnovno stanje. Zračenje neke supstance na temperaturama koje su veće od oko 500°C, naziva se toplotno zračenje i podleže Kirhofovim zakonima za zračenje apsolutno crnog tela. Luminiscencija, kao dopuna toplotnom zračenju, predstavlja zračenje u određenom spektralnom području, na određenoj temperaturi. Obično, kad kažemo luminiscencija, mislimo na zračenje u vidljivoj oblasti na temperaturama koje su manje od 500°C (“hladna” emisija zračenja). Supstance koje imaju sposobnost luminiscencije nazivamo luminoforama, dok se čvrste supstance nazivaju kristaloforama. Luminiscencija može trajati i neko vreme prestanka zračenja. Ekscitacija molekula u viša energetska stanja apsorpcijom energije vrlo je brza(10-15s) i može se odigravati na više titrajnih nivoa ekscitovanih elektronskih stanja.S obzirom na energiju koja je izazvalaluminescenciju, ona se deli na:
- fotoluminescenciju (izazvana svetlosnom energijom);
- hemiluminescenciju (energija oslobođena pri hemijskoj reakciji);
- elektroluminescenciju (izazvana električnom energijom);
- triboluminescenciju (izazvana energijom trenja);
- katodoluminiscenciju (izazvana bombardovanjem brzim elektronima);
- rentgenoluminiscencija (X–zraci);
- sonoluminiscenciju (dejstvo ultra zvuka) i dr.
Fotoluminiscencija
Fotoluminiscencija predstavlja sekundarno zračenje, koje nastaje kao rezultat apsorpcije primatnog elektromagnetnog zračenja (γ–zračenje, X–zraci, UV, vidljivo i IC zračenje). Kod procesa fotoluminescencije energija primarnog zračenja šalje elektron izosnovnog energetskognivoa, na viši energetskinivo iz koje se vraća emisijomsekundarnog zračenja. S obzirom na trajanje sekundarnog zračenja fotoluminescencijase deli se :
- fluorescenciju: ona traje dok deluje primarno zračenje,
- fosforescenciju: sekundarno zračenje traje i nakon prestanka primarnogzračenja.
Procesi apsorpcije su u oba slučaja isti.Apsorpcijom kvanta UV–svjetlosti molekulili jon, prelazi iz osnovnog singletnogstanja u pobuđeno singletno stanje gde ostaje 10-8s, za koje vreme izvodi translaciono i rotaciono kretanje, pa deo primljene energije potroši. Zbog toga emitovano svetlo imaveću λ a manju energiju od upadnog. To je Stokes-ovo pravilo. Proces neradijacione (vibracione) relaksacije traje 10-10s, a zračenje se emituje nakon 10-8–10-6 s. Fluorescencija nastupa kada se molekul koji je ekscitovan do višegoscilatornognivoasingletnog pobuđenog stanja, vraća direktno preko najnižegoscilatornog nivoa pobuđenog stanja, na bilo kojioscilatorninivo osnovnog singletnog stanja i pri tome višak energije emituje u oblikufluorescentnog zračenja(S1→ S0 + hυfl). Ako je molekul već pre izlaganjaUV zračenju sadržavaoveću energiju nego što odgovara osnovnomsingletnom stanju, energija emitovanog zračenja veća je od energije apsorbovanog zračenja.Kod rezonantne fluorescencije energije primarnog i sekundarnog zračenja su jednake.Ona se javlja kod gasova pod niskim pritiskom.Ako s višeg pobuđenog singletnognivoa ne dolazi do direktnog prelaza u osnovnosingletno stanje nego u tzv. tripletno stanje tada dolazi do fosforescencije. A. Jablonskikaže da je fosforescencija emisija iz dugo živećeg metastabilnog stanja u osnovnostanje; dugo vreme fosforescencije posledica je spinski zabranjenog prelaza. Prelaziz pobunenog singletnog stanja, dešava se nakon unutaršnjeg prelaza preko energetski nižegtripletnog stanja postepeno u osnovno singletno stanje (T1→ S0 + hυfosf).Ova spora radijaciona dezaktivacija traje 10-4–10 pa i više sekundi. Talasnadužinazračenjaemitovanog fosforescencijom veća je od one emitovane fluorescencijom.
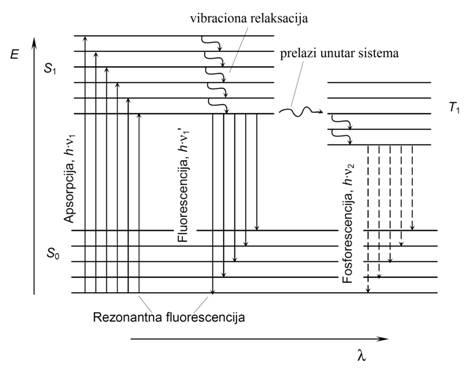
Slika 6. Energetski dijagram koji opisuje fluorescenciju i fosforescenciju i šematski opis singletnih i tripletnih stanja. S0, S1, T1–osnovno singletno, pobuđeno singletno i pobuđeno tripletno stanje saoscilatornim nivoima.
Mehanizam fluorescencije može se prikazati na sledeći način:
- proces apsorpcije
M + hν → M* E=hν=hc/λ E–energija UV zračenja
- proces emisije
M*→M + hν’ E’< Ehν’< hν E’–energija vidljivog zračenja
Efikasnost fluorescencije definiše se kvantnim prinosom fluorescencije, koji predstavlja odnos intenziteta emitovane fluorescentne svetlosti i intenziteta apsorbovane svetlosti:
![]()
Luminiscencija rastvora
Fluorescencija rastvora zavisi od mnogih faktora, što je od značaja kod praktične primene. Osim od prirode supstance ona zavisi od prirode rastvarača, koncentracije, prisustva drugih supstanci, pH i temperature. Kiselost vodenih rastvora igra veliku ulogu jer katjoni, odnosno anjoni ili molekuli nekih organskih jedinjenja često fluoresciraju, u pogledu intenziteta i spektralne raspodele, sasvim različito u zavisnosti od pH rastvora. U izvesnom vrlo uskom opsegu pH, fluorescencija nekih rastvora se menja tako naglo da ovakvi rastvori mogu da služe kao pH indikatori (tabela 8).
Tabela 8. Neki od fluorescentnih indikatora
Indikator |
pH prelaza |
Boja |
salicilna kiselina |
3,0–3,5 |
bezbojna–tamno plava |
fluorescein |
3,8–6,1 |
bezbojna–zelena |
dihlor fluorescein |
4,0–6,0 |
bezbojna–zelena |
akridin |
4,8–5,0 |
zelena–ljubičasta |
hromotropna kiselina |
6,0–7,0 |
bezbojna–plava |
Mg–8–oksiihinolin |
7,0–7,2 |
bezbojna–zlatnožuta |
kumarinska kiselina |
7,2–9,0 |
bezbojna–zelena |
Povišavanjem temperature obično se snižava intenzitet fluorescencije jer se povećanjem temperature smanjuje viskoznost rastvarača, povećava oscilatorna energija molekula, slabe unutrašnje molekulske i prelaz u osnovno stanje može se odigrati i bez emisije svetlosti (neradijaciono). Neke organske supstance ne fluoresciraju u rastvoru ni na sobnoj temperaturi, ali fluoresciraju pri mržnjenju. Priroda rastvarača dosta utiče na fluorescenciju. Molekuli koji u nepolarnim rastvaračima slabi ili uopšte ne fluoresciraju, mogu fluorescirati u jako polarnim rastvaračima, ukoliko u njemu dolazi do promene redosleda pobuđenih stanja. Osim polarnosti rastvarača bitna je i njegova viskoznost. Veća viskoznost rastvarača ometa proces sudara čime se efikasnost fluorescencije povećava. U slučajevima kada molekuli rastvarača sa supstancom grade vodoničnu vezu često dolazi do gašenja fluorescencije zbog verovatnoće neradijacionog prelaza.
Fluorescencija organskih supstanci i njihovih kompleksa
Veoma mali broj alifatičnih supstancu (uglavnom karbonilnih jedinejnja) pokazuju fluorescenciju, pre svega, zato što po pravilu, ova jedinjenja ne apsorbuju u ultraljubičastom delu spektra. Jedna od tih supstanci je i diacetil koji fosforescira u tečnom stanju. Sposobnost fluorescencije najčešće pripada organskim molekulima kojiposeduju:
- planarnu konfiguraciju odnosno relativno krutu strukturu u molekulu (npr.,metalni kompleksi),
- konjugovane dvostruke veze ili visoku rezonantu stabilnost,
- elektron donorskugrupu, npr., –NH2.
Veliki broj fluorescirajućih organskih supstanci, predstavljaju aromatična ili heterociklična jedinjenja s konjugovanim dvostrukim vezama; sve ove supstance poseduju simetrične, krute, planarne molekule. Često imaju i tautomerne i izomerne oblike. Klasični primeri fluorescirajućih ugljovodonika su: naftalin, antracen, benzapiren, akridin; poznate su i mnoge fluorescirajuće boje kao što su: akridin, azo i oksoazo boje, fluorescein, rodamin. Konjugacija nekoliko kondenzovanih prstenova i hromofornih grupi u molekulu organske supstance, praćena je promenom boje fluorescencije; maksimum fluorescencije pomera se na crvenu stranu. Veruje se da se apsorpcija i emisija zračenja javljaju na hromofornim (fluorofornim) grupama u molekulu. Ove π* ←π prelaze možemo objasnit na sledeći način. Na početku se molekul pobuđuje i obrazuje prelaznu bipolarnu strukturu ili biradikal.Ako je hromoforna grupa zaštićena supstituentom odgovarajauće strukture od uticaja sudara sa molekulima rastvora u kojem se nalazi, onda ova nestabilna struktura emituje fluorescentno zračenje, vraćanjem u osnovno stanje. U obrnutom slučaju dolazi do gašenja fluorescencije. Ako u molekul aromatičnog jedinjenja uvedemo supstituente i ako je njegova interakcija sa π–elektronima slaba, onda se prinos flurescencije ne menja značajno. Ako je pak, supstituent tako obiman da može da iskrivi planarnu strukturu molekula, onda dolazi do gašenja flurescencije.
Elektrondonorski supstituenti (OH, OR, NH2, CN) imaju tendenciju da povećavaju prinos fluorescencije, zbog povećanja verovatnoće prelaza između nižeg pobuđenog singletnog i osnovnog stanja.
Supstituenti kod kojih do apsorpcije svetlosti dolazi usled n → π* prelaza (karbonilna grupa), dovode do gašenja fluorescencije. Kada u π–elektronski sistem uvodimo atom sa većim atomskim brojem, dolazi do povećanja fosforescencije i slabljenja fluorescencije. Fluorescenciju se izaziva UV zračenjem iz UV lampi s odgovarajućim filtrom.Za kvalitativnu analizu obično se koristi živina lampa u kombinaciji s odgovarajućimoptičkim filtrima. Živine lampe mogu biti pod visokim pritiskom, i tada emituju intenzivnegrupelinija žive naλ ~ 365 nm. Kada se na takvu lampu stavi optički filter odstakla nikal oksida dobije se skoro monohromatsko svetlo najpogodnije za izazivanjefluorescencije (365 nm). Lampe koje intenzivno emituju živinu rezonantu liniju(253,7 nm) su tzv. lampe pod niskim pritiskom.Boja i intenzitet fluorescencije su karakteristične veličine, a uslovljene suhemijskom strukturom supstance i njenom koncentracijom, pazavise od pH, temperature irastvarača. Boja fluorescencije može se posmatrati u stubu tečnosti u epruveti, na sahatnomstaklu ili na filter papiru. Rastvaraččesto utiče na fluorescenciju supstance pa o tome treba voditi računa. Merenjeintenziteta fluorescencije temelj je fluorimetrijske kvantitativne analize.
U organskoj analizi koristimo činjenicu da mnogi tipovi organskih molekulafluoresciraju ili mogu biti prevedeni u fluorescirajuće molekule. Proteini i druge biološki aktivne supstancečesto stvaraju kompleksnajedinjenja koji dobro fluoresciraju.Fluorescencija i hemiluminescencija služe za dokazivanje i određivanje tragovametabolita lekova, vitamina, npr., tiamina (B1), riboflavina (B2) i tokoferola (E) ubiološkim tkivima i tečnostima, za određivanje kinina, u kontroli kvaliteta doziranjalijekova, itd. Nadalje, adsorbati često pokazuju intenzivnu fluorescenciju (npr.,hromatografske mrlje). Na osnovu fluorescencije prate se i mnoge enzimske reakcije.U neorganskoj analizi fluorescencija služi najčešće za određivanje metalnih jona uobliku fluorescirajućih helata s organskim reagensima (s oksinom, morinom). S oksinom fluorescirajuće taloge daju Zn2+ i Al3+. Dalje, Al3+možemo dokazati ili odrediti s morinom koji s jonom aluminijuma daje helat koji pokazujeintenzivnu žuto–zelenu fluorescenciju. Važna reakcija fluorescencije je ireakcijajona Na+s cinkuranil–acetatom, kojom nastaje zeleno fluorescirajući talog.
Primese (joni i molekuli) prisutne u uzorku mogu uticati na fluorescencijuinhibitorski ili aktivatorski. Ova se svojstva mogu koristiti za njihova određivanja jer suefekti proporcionalni koncentraciji aktivatora, odnosno inhibitora.Inhibitorski deluju mnogi metalni i drugi joni (npr., Mn, Ni, Co, J-, Br-, NO2-,-COO-). Teški metali kao inhibitori, npr., Hg2+, smanjuju fluorescencijukompleksiranjem. Pod delovanjem inhibitora, fluorescencija jedinjenja pod UV svetlošćuslabi. Inhibitorsko delovanje smanjuje kvantni prinos. Ono se može tumačiti:
- apsorpcijom primarnog zračenja; to je tzv. efekt "unutrašnjeg filtra". Čestica gasioca(inhibitor) oduzima apsorpcijom deo primarnog zračenja supstanci koja fluorescira.Time joj ustvari smanjuje mogućnost apsorpcije i emisije. Oduzimanje energije moženastupiti zbog kidanja veze;
- fizičko–hemijskom interakcijom između molekula fluorescentne supstance i molekula gasioca.
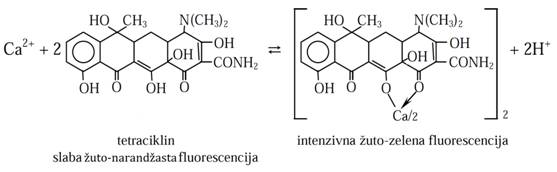
Aktivatorsko delovanje se sastoji u tome da, supstanca koja pokazuje neznatnu fluorescenciju dodavanjem, npr. jona lakih metala (Ca, Ba, Mg), stvara komplekse kojipokazuju znatno jaču fluorescenciju. Npr., antibiotik tetraciklin pod UV svetlošću pokazuje slabu narandžastu fluorescenciju u čvrstom stanju i u rastvoru, a njegovim helatiranjem s lakim metalima (Ca, Mg (zelena fluorescencija), B) intenzitetfluorescencije se pojačava proporcionalno koncentraciji jona, pa je moguće određivanjeovih jona:
Npr., moguće je odrediti tetraciklin u serumu nakon prevođenja u anhidrotetraciklin ikompleksiranja sa Al3+ u CHCl3 (λakt = 475 nm, λem = 550 nm).
Hemiluminiscencija organskih supstanci i njihovih kompleksa
Energija pobuđivanja oslobađa se u hemijskoj reakciji. Produkt reakcije
nastaje uekscitovanom elektronskom stanju. Reakcije hemiluminescencije
mogu se koristiti zadokazivanje i određivanje, npr., za određivanje organofosfornih
jedinjenja (pesticida ibojnih otrova kao što su tabun, sarin) jer je intenzitet
emisije svetla proporcionalankoncentraciji organofosfornog jedinjenja:
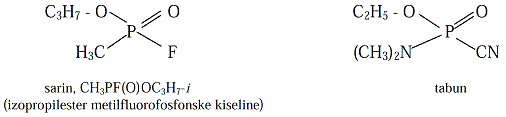
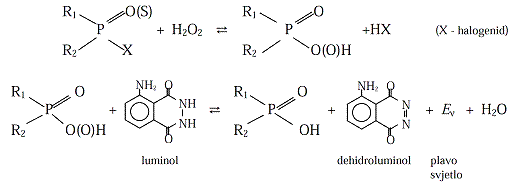
Insekticid odnosno nervni bojni otrov je katalizator, odnosno prenosilac
kiseonika u reakciji sa luminolom. U hemiluminometrijskim biosenzorima
detekcija H2O2 s luminolom koristi se zapraćenje reakcija koje katalizuju
oksidaze. Na tom se principu može odrediti i sadržajholina i acetilholina.
Primena organskih reagenasa u analitičkoj hemiji
Teoretska razmatranja o kompleksima potrebna su za predviđanje reakcija urastvorima kompleksa zavisno od analitičkog cilja. Tu su mogućnosti neograničene uzupotrebu organskih reagenasa. Analitički značaj kompleksa je ogroman; njih koristimou kvalitativnoj i kvantitativnoj analizi, za razdvajanje, maskiranja i demaskiranja analita. Jedna od metodasprečavanja ili usmeravanja taloženja je stvaranje jakih kompleksa. Primenomodgovarajućih liganada može se povećati i selektivnost analitičkih postupaka. Tako nekiligandi stvaraju stabilne komplekse sa samo nekoliko metalnih jona. Na primer, DMG sa Ni2+, Pd2+ i Fe3+stvara nerastvorne komplekse, ali i rastvorne komplekse s drugimjonima (Fe2+, Co2+, Cu2+). Joni gvožđamogu se maskirati, pa je DMG selektivan za Ni2+ i Pd2+.
Osetljiva dokazivanja analita moguće je izvesti stvaranjem ili razaranjemkompleksa. Stvaranje obojenog ili fluorescirajućeg kompleksa omogućuje dokazivanjepojedinog jona ili organskog jedinjenja. Tako npr., stvaranje kompleksa [FeSCN]2+ je dokazprisustva Fe3+ ili SCN-. Crveno–ljubičasti kompleks Zn–ditizonadokazuje prisustvo Zn2+ a žuto obojeni [BiJ4]- karakteriše prisustvo Bi3+. Reakcijenastajanja lako ili teško rastvornih obojenih kompleksnih jedinjenja, često se izvode kaoreakcije u kapi. Reakcije kompleksiranja kojima nastaju obojeni produkti temeljsu, ne samo reakcija dokazivanja, nego i spektrometrijskih postupaka određivanja jona ilimolekula u vodenojsredini ili organskom rastvaraču.
Primena helata u analitičkoj hemiji je velika jer su helati visoke stabilnosti i često suintenzivno obojeni. Nastajanje rastvornih, odnosno nerastvornih koordinacionihjedinjenjačini osnovu niza kvantitativnih metoda analize kao što su kompleksometrijska,fluorimetrijska, gravimetrijska ili spektrometrijska određivanja. Tako, npr., polidentatniligandi koji stvaraju naelektrisane, u vodi rastvornehelate koriste se u volumetrijskoj analizi, aneutralni, u vodi nerastvorni helati koriste se u gravimetrijskoj analizi i ekstrakcijiorganskim rastvaračem. Razdvajanja primenom koordinacionihjedinjenja moguće jeizvesti na osnovu razlike u njihovim Kspvrednostima, ili postupcima ekstrakcijeorganskim rastvaračem, na jonskim izmenjivačima ili na drugim stacionarnim fazama.
Fotometrijska određivanja u analitičkoj hemiji
Fotometrijska određivanja neorganskih supstanci pomoću organskih reagenasa najčešće se zasnivaju na reakcijama stvaranja produkta koji apsorbuje zračenje tačno određenih frekvencija. Tako se kod spektrofotometrijskih, kolorimetrijskih ili turbidimetrijskih određivanja meri apsorpcija zračenja u UV ili vidljivoj oblasti spektra. Fluorimetrijske (fosforimetrijske) metode zasnivaju se na merenju fluorescencije iil fosforescencije. Nefelometrijske metode, koje se zasnivaju na merenju intenziteta rasipanog zračenja na koloidnim česticama, upotrebljavaju se ređe.
Kolorimetrija, spektrofotometrija i turbidimetrija
Kolorimetrijskim metodama vrši se određivanje koncentracije obojenih rastvora, znači rastvora koji apsorbuju u vidljivoj ili bliskoj UV oblasti elektromagnetnog spektra. Boja koju ima rastvor neke supstance, komplementarna je boji koju ta supstanca apsorbuje. Na primer, akva bakar(II) jon je bledo plave boje, sto ynači da apsorbuje u žutom delu elektromagnetnog spektra. Veza između talasne dužine zračenja i boje apsorbovane i propuštene svetlosti data je u tabeli 9.
Tabela 9. Veza između talasne dužine zračenja, boje apsorbovane i boje propuštene svetlosti
λ (nm) |
Apsorbovana boja |
Propuštena boja |
380–435 |
ljubičasta |
žuto–zelena |
435–480 |
plava |
žuta |
480–490 |
zeleno–plava |
narandžasta |
490–500 |
plavo–zelena |
crvena |
500–560 |
zelena |
purpurna |
560–580 |
žuto–zelena |
ljubičasta |
580–595 |
žuta |
plava |
595–650 |
narandžasta |
zeleno–plava |
650–780 |
crvena |
plavo–zelena |
Kolorimetrijskim metodama količina neke obojene supstance u rastvoru, određuje se poređenjem intenziteta boje rastvora sa intenzitetom boje standardnih rastvora, tj. rastvora poznatih koncentracija ispitivane supstance. Koncentracija nepoznatog rastvora jednaka je koncentraciji onog standarda koji ima isti intenzitet boje kao i nepoznati rastvor. Kako su koncentracije dva rastvora jednake, sledi da su im i apsorbance jednake, a na osnovu Lambert–Beer–ovog zakona dolazimo do sledećeg:
A=εc1![]() 1=εcx
1=εcx![]() 2→c1
2→c1![]() 1=cx
1=cx![]() 2
2
Spektrofotometrija se znatno više koristi od kolorimetrije, a zasniva
se na proučavanju zavisnosti apsorbance ili apsorbtiviteta od talasne
dužine monohromatskog zračenja koje je prošlo kroz rastvor analizirane
supstance. Apsorpcija se meri spektrofotometrima, koji su snadbeveni prizmom
ili rešetkom (služi kao monohromator) i fotoelemntom (ili fotomultiplikatorom).
Kvantitativna analiza zasniva se na Lambert–Beer–ovom zakonu.
Kod turbidimetrije merenje intenziteta vrši se kao i kod kolorimetrije
i spektrofotometrije s tom razlikom, što umesto homogenih rastvora koristimo
heterogene sisteme (suspenzije, koloidne disperzije).
Kolorimetrijske rekcije i organski reagensi
Reakcije neorganskih suspstanci sa organskim reagensima, koje vode obrazovanju obojenih produkata, a koje su pogodne za kolorimetrijsko, spektrofotometrijsko i turbidimetrijsko određivanje, nazivaju se kolorimetrijskim (obojenim) rakcijama. Kod kolorimetrijskih reakcija, kao produkti javljaju se soli metala ili kompleksi. Međusobnim dejstvom metala sa organskim reagensom, dolazi do stavaranja obojenih kompleksa tipa MLnili mešovitih kompleksa tipa MLnYm. Najopštiju primenu našli su sledeći organski reagensi:
Ligandi sa donor atomima O,O.
Ovaj niz reagenasa uključuje polifenole i aromatične hidroksi kiseline, kao što su 5–sulfosalicilna kiselina, hromotropna kiselina (4,5–dihidroksinaftalen–2,7–disulfonska kiselina), tiron (dinatrijumova so katehol–3,5–disulfonske kiseline) i dr.
Ovi organski reagensi obrazuju obojene helate sa prelaznim metalima, kao što su Fe(III), Ti, V. Sa tironom Fe(III) gradi tamno plavi obojeni kompleks na pH ispod 5,6. Tiron sa Ti gradi žuto do narandžasto bojene komplekse.
Kao organske reagense ovog tipa treba navesti i derivate alizarina (1,2–dihidroksiantrahinon), fluoron i različite boje, kao što su aurintrikarboksilna kiselina (aluminon je amonijumova so ove kiselina), eriohrom cijanin R. Ovi reagensi nalaze najčešću primenu za spektrofotometrisko određivanje Al, Mg, Ga, Sc, Zr, Ge, Sn, sa kojima po pravilu grade komplese slabo rastvorne u vodi.
Ligandi sa donor atomima N,N ili O,N.
Aromatična azotna jedinjenja kao što su 1,10–fenantrolin, 2,2'–dipiridil i njihovi derivati, uglavnom se koriste za određivanje Fe(II) i Cu(I). Sa ovim metalima oni obrazuju crvene ili žute katjonske komplekse.
2–oksiazo i azometinske boje kao što su, PAN (1–(2–piridilazo)–2–naftol), PAR (4–(2–piridilazo)rezorcin), torin, arsenazo, eroihrom crno T i dr., mogu obrazovati sa nizom metalnih jona intenzivno obojene komplekse, koji su u većini slučajeva nejonske prirode. Ovi reagensi se često koriste u ulozi metalohromnih indikatora.
LigandisadonoratomimaS,SiliS,N.
Ovi organski reagensi sadrže tionske ili tiolske grupe, kao što je to slučaj kod ditiokarbamata, ditizona, ditiola, 8–merkaptohinolina, ksantata itd. S velikim brojem metala, koji daju nerastvorne sulfide, oni grade komplekse sa tamnom bojom. Ovi helati obično su rastvorni u organskim rastvaračima, na primer, ugljen tetrahloridu, hloroformu, itd.
Spektrofotometrijske metode. Selektivnost spektrofotometrijskih metoda.
Spektrofotometrijske metode (metode molekulske apsorpcione spektrometrije) zasnivaju se na merenju apsorpcije zračenja u vidljivoj i bliskoj UV oblasti, od strane obojenih jedinjenja, koja formiraju elementi koji se određuju, pre samog određivanja. Spektrofotometrijske metode se karakterišu visokom raznovrsnošću, osetljivošću i preciznošću.
Spektrofotometrijskim metodama se mogu odrediti skoro svi hemijski elementi u širokom opsegu koncentracija, od makrokoličina (korišćenjem diferencijalne spektrofotometrije) pa do elementa u tragovima. Spektrofotometrijske metode spadaju u jedne od najpreciznijih instrumentalnih metoda.
Osetljivost spektrofotometrijskih metoda se obično izražava preko molarnog apsorpcionog koeficijenta (ε=l·mol-1·cm-1) koji je izmeren na talasnojdužini na kojoj se meri i apsorbanca. Kod osetljivih spektrofotometrijskih metoda vrednost molarnog apsorpcionog koeficijenta je obično veća od 2·104, dok vrednost molarnog apsorpcionog koeficijenta ispod 1·103ukazuje na metodu male osetljivosti. Osetljivost spektrofotometrijskih metoda pogodno je izraziti i pomoću specifične apsorbance (a) koja se dobija tako što se ε podeli sa molarnom masom elementa i sa 1000. Vrednost a odgovara apsorbanciji rastvora datog elementa u koncentraciji od 1μg/ml (1 ppm), u kiveti debljine 1 cm. Vrednostε se najpreciynije određuje pod uslovima kaka spektrofotometrijski reagens ima A=0 na talasnoj dužini maksimalne apsorpcije kompleksa (λmax), i kada se samo jedan stabilan obojeni kompleks formira u sistemu. Teže je odrediti vrednost ε u slučajevima kada reagens i sam apsorbuje zračenje na λmax. U slučaju da se formira samo jedan obojeni kompleks u sistemu, apsorbanca se može meriti u odnosu na referentni rastvor u kojem je koncentracija reagensa identična koncentraciji neizreagovanog reagensa u mernom rastvoru. Određivanje koeficijenta ε je vrlo jednostavno kod ekstrakciono–spektrofotometrijskih metoda. U većini slučajeva ekstrakcija je povezana sa transformacijom dihromatskog rastvora u monohromatski. Nekoliko kompleksa može postojati u vodenom rastvoru, a ekstrakt sadrži samo jedan kompleks tačno određenog sastava. Ekstrakcija vodi povećanju osetlivosti metode. Kod nekih metoda, osetljivost zavisi od kvaliteta reagensa koji se koristi za izvođenje bojene reakcije. Ovo je posebno važno kod reagenasa prirodnog porekla, iako su neke razlike primećene i kod sintetičkih organskih reagenasa. Razlike u osetljivosti rezultat su prisustva nekih dodatnih smeša koje utiču na reakcije elementa koji se određuje, ili dovode do povećanja kompetitivnih reakcija.
Selektivnostbojenih reakcija i odgovarajućih metoda određivanja zavisi od prirode korišćenog reagensa, stepena oksidacije elementa koji se određuje, pH analitičke sredine, i kompleksirajućeg agensa koji se koristi za maskiranje nterferirajućih jona. Postoji veoma mali broj specifičnih reagenasa i reakcija. Jedni od tih retkih primera su: kuproin za određivanje Cu(I) ii batofenantrolin za Fe(II). Selektivnost većine metoda, može se povećati odgovarajućim izborom pH sredine.
Za reagense tipa R–OH postoji veza između bojenih reakcija i hidrolitičke reakcije određenih elemenata. U jako kiselim rastvorima, bojene rakcije odigravaju se sa onim elementima koji imaju lako hidrolizabilne katjone, kao što su Zr, Hf, Th, U(IV) i Ti. U umereno kiselim rastvorima reakcije se odvijaju i sa Fe(III), Al i U(IV), dok se u slabo kiselim i neutralnim rastvorima odigravaju reakcije sa elemntima retkih zemalja, Fe(II), Cu, Mn. U alkalnim rastvorima odigravaju se reakcije sa Ca, Sr i Mg. lako hidrolizabilne vrste reaguju u kiselijim rastvorima, dok drugi joni reaguju u manje kiselim.Reagensi tipa R–SH reaguju u kiselim uslovima sa katjonima druge analitičke grupe (Hg2+, Bi3+, Cu2+, As(III), As(V), Sn2+, Sb3+) koji formiraju najstabilnije sulfide. U slabo kiselim i neutralnim rastvorima reaguju sa metalnim katjonima treće analitičke grupe (Fe2+, Fe3+, Cr3+, Al3+).
pH obojenih rastvora često se stabilizuje pomoću pogodnih pufera. Tartaratni, citratni, fosfatni i ftalatni puferi se obično izbegavaju pošto oni mogu da grade stabilne komplekse sa većim brojem metala. Najčešće se koristi acetatni pufer, mada se on može zameniti i heksametilentetraaminskim puferom. Selektivnost se može povećati i maskiranjem interferirajućih jona. Maskiranje se sastoji u konverziji interferirajućih jona u stabilan kompleks koji se formira sa kompleksirajućim agensom koji se dodaje.
Tabela 10. Najzastupljeniji maskirajući reagensi
Element |
Maskirajući agens |
Element |
Maskirajući agens |
Ag |
CN-, S2O32-, I-, Cl-, NH3 |
Mn |
EDTA, okslati, citrati |
Al |
F-, acetat, tartarat, EDTA, OH- |
Mo |
F-, H2O2, citrati, EDTA |
As |
S2-, OH- |
Nb |
F-, tartarti, H2O2 |
Au |
CN-, Cl-, Br-, S2O32- |
Ni |
CN-, NH3, EDTA |
B |
F-, hidroksi kiseline |
Os |
Cl-, SCN-, CN- |
Ba |
EDTA, citrati, SO42- |
Pb |
acetati, citrati, tartarati, EDTA, SO42-, I- |
Be |
F-, citrati, tartarati |
Pd |
CN-, citrati, tartarati, EDTA, SO42-, I- |
Bi |
citrati, EDTA, I- |
Pt |
I-, CN-, NO2-, NH3 |
Ca |
EDTA, citrati, tartarti |
Rh |
Cl-, citrati, tartarati |
Cd |
EDTA, CN-, I-, tartarati |
Ru |
CN-, Cl- |
Ce |
F-, citrati, EDTA |
Sb |
tartarati, I-, S2-, OH-, F- |
Co |
SCN-, NH3, EDTA |
Sc |
citrati, EDTA |
Cr(III) |
EDTA, citrati, tartarti |
Sn |
tartarati, S2-, OH-, F- |
Cu |
CN-, NH3, EDTA, S2O32-, citrati |
Sr |
SO42-, EDTA, citrati |
F |
H3BO4, Al, Be, Ti |
Ta |
F-, citrati, tartarati |
Fe(III) |
F-, PO43-, EDTA, tartarti |
Th |
F-, EDTA, citrati, acetati |
Fe(II) |
CN-, F-, fenantrolin |
Ti |
H2O2, citrati, I- |
Ga |
EDTA, citrati, tartarti |
Tl |
EDTA, Cl-, citrati, tartarati |
Ge |
oksalati, F- |
U |
F-, CO32-,H2O2, citrati |
Hg |
CN-, Cl-, I- |
V |
F-,H2O2, EDTA |
In |
EDTA, Cl-, citrati |
W |
F-,H2O2, tartarati, citrati |
Ir |
Cl-, SCN-, NH3 |
Zn |
CN-, NH3, EDTA, OH- |
Mg |
EDTA, okslati, tartarati |
Zr |
F-, PO43-,H2O2, citrati, oksalati |
Visoka selektivnost u spektrofotometriji postiže se izborom odgovarajućeg kompleksirajućeg agensa i odgovarajuće pH. Stabilnost kompleksa nije konstantna, ali se menja sa promenom pH i drugih parametara, kao što su koncentracija maskirajućeg agensa i prisustvo drugih kompleksirajućih agenasa. Iako je broj poznatih specifičnih reagenasa veoma mali, postoje neke metode koje se zasnivaju na primeni grupe reagenasa (koji reaguju sa više elemenata), koji u prisustvu odgovarajućeg maskirajućeg reagensa i odgovarajuće pH reaguju specifično. Primer ovakvih sistema mogu biti određivanje Zn–a sa ditizonom na pH 4–5, u prisustvu tiosulfata, ili određivanje Al–a sa 8–hidroksihinolinom na pH 9, u prisustvu EDTA, cijanidina i H2O2 kao maskirajućih agenasa.
Obojeni sistemi u spektrofotometriji
Većina obobjenih sistema, koji se koriste kao osnova spektrofotometrijskog odrđivanja, nastaju kao rezultata kompleksirajućih reakcija. Velika grupa metoda zasniva se na primeni difunkcionalnih organskih reagenasa koji sa metalnim jonima formiraju unutrašnje helate, rastvorne u nepolarnim rastvaračima. Ovakvi reagensi se koriste u ekstrakciono–spektrofotometrijskim metodama, a obuhvataju sledeće reagense: ditizon, ditiokarbamate, 8–hidroksihinolin, 1–nitrozo–2–naftol, dioksime i PAN (1–(2–piridilazo)–2–naftol).
Druga grupa metoda zasniva se na upotrebi organskih reagenasa koji daju naelektrisane, u vodi rastvorne komplekse. Ovi reagensi sadrže hidrofilne, uglavnom sulfonske grupe. Ove tipove kompleksa formiraju arsenazo III, PAR (4–(2–piridilazo)rezorcinol), 2–(5–Br–2–piridilazo)–5–dietilaminofenol (5–Br–PADAP), eriohrom crno T, hrom azurol S, bromopirogalol crveno. Katjonski kompleksi metal formiraju se u reakciji sa 1,10–fenantrolinom ili kuproinom.
Velika grupa osetljivih metoda zasniva se na formiranju ternarnih kompleksa. Reakcije lako hidrolizabilnih metalnih jona (npr., Be, Al, In, Sc, Ti, Th, Fe(III), Zr) sa nekim helatirajućim hromogenim reagensima, daju jako obojene ternarne komplekse (sa velikim batohromnim pomeranjem reda 100–200 nm) u prisustvu surfikanata. Među najčešće korišćenim katjonskim surfikantima su bromidne i hloridne soli cetiltrimetilamonijuma, cetilpiridinijuma i tetradecildimetilbenzilamonijuma.
Bazne boje (trifenilmetanske, ksantenske, azinske i druge boje) formiraju jonske asocijate (jonske parove) sa anjonskim halidnim kompleksima metala i nemetala (npr., SbCl6-, AuBr4-, TaF6-). Rezultujuće jedinjenje, koje može biti ekstrahovano nepolarnim organskim rastvaračem, može služiti kao osnova za senzitivne spektrofotometrijske metode. Jonski asocijati koje je moguće ekstrahovati, mogu se formirati i u reakciji heteropoli kiselina sa baznim bojama.
Druga grupa metoda zasniva se na formiranju jonskih asocijata u reakciji kiselih boja (eozin, metil oranž, bengalsko roze) sa hidrofobnim katjonskim kompleksima nekih metala (npr., Fe(II), Ag(I), Zr, Cd), koje oni formiraju sa 1,10–fenantrolinom i drugim organskim bazama. Sa metalnim jonima, neki organski reagensi formiraju obojene komplekse koji su umereno rastvorni i u vodi i u organskim rastvaračima. To su ili polinuklearni kompleksi, kao oni koje formira fenilfluoron sa Sn(IV) ili sa Ge(IV), ili jedinjenja adsorpcionog tipa kao ona koja se formiraju u reakciji titanijum žutog i Mg. U tim slučajevima, meri se apsorbanca suspenzije, obojenog pseudo–rastvora, koji je stabilizovan nekim zaštitnim koloidom (želatin, polivinil alkohol, gumarabika).
Kompleksi metalnih jona sa neorganskim reagensima se takođe primenjuju kod spektrofotometrijskih metoda, npr., tiocijanati (Fe(III), Co, Nb, Mo, Re, W, U, Ti), jodidi (Bi, Sb, Pd) ili vodonik peroksid (Ti, V, U).
Grupa elemenata (P, As, Si, Ge, V, W, Mo, itd.) formira žute heteropoli kiseline, koje kada se redukuju daju plavo obojene komplekse. I heteropoli kiseline i njihovi redukovani oblici koriste se za određivanje elemenata. Oba oblika se mogu ekstrakovati rastvaračima koji sadrže kiseonik. Treba napomenuti da heteropoli kiselinski anjoni formiraju ekstracibilne jonske asocijate sa osnovnim bojama.
Obojeni sistemi pogodni za spektrofotometrijsko određivanje mogu se formirati u redoks reakcijama. Neki primeri takvih reakcija su: oksidacija Mn(II) do MnO4- ili Cr(III) do CrO4-; oksidacija oksidacija dimetilnaftidina vanadijumom(V) ili hromom(VI); oksidacija o– tolidina cerijumom (IV) ili hlorom. Primeri oksidacionih reakcija su jodidne metode, gde jodidni joni oksidovani bromom, daju jodatne jone, koji reaguju sa viškom jodidnih anjona i daju slobodan jod.
Kod nekih metoda obojeni sistem je produkt sintetičke reakcije. Primeri ovakvih metoda su: formiranje indofenolnih boja u metodi određivanja amonijaka; sinteza azo boja tokom određivanja nitrita; formiranje metilenskog plavog prilikom određivanja sumpora, itd.
Postoje i indirektne spektrofotometrijske metode gde određivani element izaziva promenu boje. Ova grupa metoda se najviše sastoji od metoda za određivanje fluorida. Kako su sposobni da formiraju stabilne komplekse sa nekim metalima, fluoridni anjonimogu da razore boju kompleksa tih metala. Tako, metoda koja uključuje sulfosalicilni kompleks Fe(III), boja rastvora se obezbojava fluoridnim anjonima. Drugi primer je određivanje fosfata pomoću lantan–hloranilata. Fosfatni anjoni reaguju i formiraju manje rastvorni LaPO4, a oslobađaju se obojeni hloroanilatni joni.
Spektrofotometrijski reagensi
Azo reagensi (Azo boje)
Azo boje obuhvataju veliku grupu spektrofotometrijskih organskih reagenasa. Ova grupa obuhvata reagense kao što su: PAN, PAR,5–Br–PADAP, arsenazo III, hlorofosfonazo III. Metode koje se koriste azo bojama su osetljive.
N–heterociklična azo jedinjenja
PAN (1–(2–piridilazo)–2–naftol) u rastvoru može postojati u tri oblika zavisno od pH rastvora. Kiseli rastvori (pH ≤ 2) sadrže rastvoran u vodi, žuto–zeleni protonovani H2R+ jon. Između pH 3 i 11 javlja se kao neutralni žuti molekul, rastvoran u organskim rastvaračima (u vodenim rastvorima može se formirati koloidna suspenzija). U alkalnim rastvorima pH ≥ 11 kao crveni anjon R-, rastvoran u vodi. Najčešće se koristi kao metanolni ili etanolni rastvor. Ponaša se kao terdentatni ligand, a kompleksira se sam etalnim jonima preko atoma kiseonika hidroksilne grupe, atoma azota sa piridina i preko jednog od atoma azota azo grupe. Metalni kompleksi ovog reagensa su umereno rastvorni u vodi. Metalni joni formiraju neutralne komplekse koji se mogu ekstrahovati inertnim rastvaračim (hloroform ili benzen). Na ovaj način moguće je ekstrakciono–spektrofotometrijsko određivanje Mn, Zn, Cd, Cu, Ni, Co, In, U, Ga i Pd. Molarni apsortivitet metalnih kompleksa sa PAN – om nalazi se u oblasti 2–6·104. Selektivnost metoda koje koriste PAN poboljšava se odgovarajućim izborom pH i maskirajućeg agensa. Gvožđe, kobalt i nikl reaguju sa ovim reagensom na pH = 4. Na ovoj pH vrednosti ne reaguju Mn, Zn i Cd. Cijanidin omogućava određivanje Mn u prisustvu Ni, Zn, Co, Cd i Cu, sa kojima stvara stabilne komlekse. Zn i Cd mogu se demaskirazi iz kompleksa sa cijanidinom pomoću formaldehida.
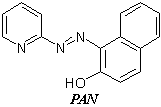
PAR (4–(2–piridilazo)rezorcinol)
je rastvoran u vodi i sa metalnim jonima formira komplekse rastvorn u
vodi. U opsegu od 90% H2SO4 do pH 2, javljaju se sledeći protonovani oblici:
H5R3+, H4R2+ i H3R+. U neutralnom obliku PAR se nalazi na pH između 2,1
i 4,2 (λmax = 385 nm). U obliku anjona HR-(λmax = 413 nm) nalazi se na
pH između 4,2 i 7, dok su u alkalnom rastvoru (pH 11–13) obe hidroksilne
grupe disosovane. Oblik R2- apsorbuje na λmax = 490 nm. Sa metalnim jonima
PAR daje obojene komplekse. Određivanje metala sa PAR–om se izvodi u vodenoj
sredini. U 0,5–0,05 M H2SO4 ovaj reagens reguje sa Cu, Bi, Ti, Zr, Pd,
i Tl(III). U acetatnoj sredini (pH 3–6) daje obojene reakcije sa Zn, Cd,
Co, Ni, Hg, U, Pb i Ga. Rastvori PAR kompleksa su obojeni crveno ili ljubičasto.
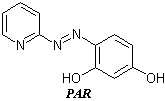
Bromo i hloro–piridilazo derivatisu veoma bitni,
zbog toga što predstavlaju osnovu visoko osetljivih metoda. Njihovi kompleksi
sa metalnim jonima imaju molarnu apsorptivnost oko 105. Najširu upotrebu
ima 2–(5–bromo–2–piridilazo)–5–dietilaminofenol (5–Br–PADAP),
koji je osnovni reagens kod jako osetljive metode određivanja Cd, Co,
Ni i drugih metala. Drugi reagensi iz ove grupe su:2–(5–hloro–2–piridilazo)–5–dietilaminofenol
(5–Cl–PADAP); 4–(5–bromo–2–piridilazo)–1,3–diaminobenzen (5–Br–PADAB)
i 2–(3,5–dibromo–2–piridilazo)–5–dietilaminofenol (3,5–diBr–PADAP)
i svi se koriste za određivanje U i Zr.
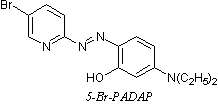
Tiazol azo jedinjenja imaju slične osobine
kao Pan i PAR kao spektrofotometrijski reagensi. Njihove reakcije sa metalima
su osetljivije, pre svega zbog manje stabilnosti njihovih kompleksa. Reagensi
iz ove grupe su: 1–(2–tiazolilazo)–2–naftol (TAN) i 4–tiazolilazo
rezorcinol (TAR).
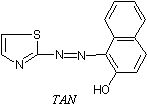
Arsenatna azo jedinjenja
Prvi reagensi ove grupe su Arsenazo I(1,8–dihidroksinaftalen–3,6–disulfonska
kiselina) iToron I. ova grupa reagenasa karakteriše se prisustvom
kisele arsenatne grupe u orto položaju u odnosu na azo grupu. Prisustvo
ove grupe AsO3H2, dovodi do formiranja stabilnih kompleksa nekih metala
čak i u prilično jakim kiselim rastvorima. Prisustvo azo grupe, osigurava
bojenu reakciju, dok hidroksilna grupa omogućava formiranje drugog prstena
sa metalom. Ovo ne samo da stabilizuje kompleks, nego i omogućava da se
dobije značajno tamnija boja. Arsenazo I upotrebljava se za određivanje
elemenata retkih zemalja (Th, U, Zr, Ti, Nb) i drugih metala. Toron I
je manje osetljiv od Arsenazo I, a najčešće se upotrebljava za određivanje
torijuma, Li, U, Zr i Be.
Arsenazo III su veoma korisne bis–azo boje koje
se sastoje od hromotoropne kiseline i o–aminofenilarsenatne kiseline.
Umereno su rastvorne u neutralnim i kiselim rastvorima, a lako rastvorne
u blago alkalnim rastvorima. Jaki oksidujući (H2O2, Br2, Cl2) i jaki redukujući
agensi dovode do razaranja ove boje. U kiselim rastvorima (od 10 M hlorovodonične
kiseline do pH = 4), arsenazo III ima purpurno–crvenu boju, dok je na
većim pH vrednostima plavo–ljubičast. U jako kiselim rastvorima (1–10
M HCl) arsenazo III reaguje samo sa Th, Zr, Hf i U(IV). Molarni apsorptivitet
kompleksa ovih metala je oko 105.Na pH 1–4 reaguje sa U(VI), Sc, Fe(III),
Bi i retkim zemljama. Osetljivost ovih obojenih reakcija je nešto niža,
oko 5·104. Upotrebom arsenaza III u jako kiselim rastvorima, prevazilaze
se poteškoće povezane sa hidrolizom nekih multivalentnih metala. Apsorbanca
slobodne Arsenazo III (λmax = 520–530 nm), na apsorpcionom maksimumu metalnih
kompleksa (λ = 655–665 nm) je veoma mala. Samo jedna strana simetričnog
molekula učestvuje u formiranju kompleksa sa metalnim jonima. Metalni
jon vezuje se za azotov atom azo grupe, kiseonikov atom arsenatne grupe
i kiseonikov atom hidroksilne grupe. Arsenazo III mogu’e je odrediti u
sredini koncentrovane sumporne kiseline na 675 nm. Pod ovim uslovima arsenazo
I ne apsorbuje.
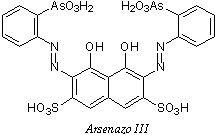
Druga azo jedinjenja
Mnoge druge klase azo jedinjenja , kao što su o,o’–dihidroksiarilazo
jedinjenja koriste se u spektrofotometrijskoj analizi različitih
metala. Primer ove grupe reagenasa je Sulfohlorfenol S, koji
služi za određivanje Nb, Zr, Mo, Cu, V i Al u kiseloj sredini.
Analog Sulfohlorfenola S, Sulfonitrofenol M kod koga su dva hloridna
atoma zamenjena nitro grupama. Ovaj reagens primenjuje se za određivanje
Pb, Nb, Al, Ga, Zr i V. Drugi primeri o,o’–dihidroksarilazo
jedinjenja su: pikramin–epsilon, i poznati reagens za određivanje
magnezijuma Eriohrom crno T i Kalmagit. Tu su još i
Hromotrop 2B, reagens koji služi za određivanje torijuma i retkih
zemalja, i 2–(4–sulfofenilazo)hromotropna kiselina
(SPADNS), koja se koristi za određivanje Al, Zn, Th, U i drugih metala.
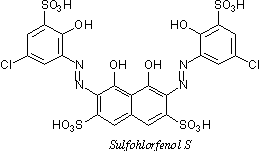
Trifenilmetanski reagensi
Zahvaljujuići prisustvu p–hinonoidnih prstenova, trifenilmetanski
reagensi su veoma intenzivno obojeni i obezbeđuju osnov za spektrofotometrijsko
određivanje velikog broja metala.
Pirokatehol Violet je vrlo često korišćeni helatirajući
reagens, lako rastvorljiv u vodi i vodenom rastvoru etanola. Vodeni rastvor
ovog reagensa je žut (pH 1–8), a boja se menja ka ljubičastoj povećanjem
pH vrednosti, kao rezultat disocijacije protona sa hisroksilne grupe.
Pirokatehol violet gradi obojene (najčesšće plave) helate sa velikim brojem
metala (Be, Al, Bi, Co, Cu, Fe, Ga, In, Mn, Pb, V, Zn) u slabo kiselim
i slabo baznim rastvorima.
Eriohrom Cijanin R (ECR)iHrom Azurol S pored hidroksilnih i sulfonatnih grupa poseduju i karboksilatne grupe. Ovi reagensi mogu da reaguju sa velikim brojem metala u slabo kiselimi neutralnim rastvorima. Žuto–narandžasta boja reagenasa menja se u plavu ili ljubičastu boju rastvora helata.
Ksilenol Oranž i Metiltimol Plavo karakterišu se prisustvom imidoacetatnih grupa, koje se javljaju kod kompleksona kao što je EDTA.
Površinski aktivne supstance, katjonski i nejonski surfikanti, olakšavaju disocijaciju protona helatirajućih trifenilmetanskih reagenasa, a kao posledica toga olakšana je reakcija ovih hromogenih reagenasa sa lako hidrolizabilnim metalima (Be, Al, Ga, In, Fe(III), Sc, Ti, Zr).
Ksantenski reagensi
Među najčešće korišćenim helatirajućim ksantenskim reagensima su: Galein,
Bromopirogalol Crveno, Pirogalol Crveno. Ksantenski
reagensi formiraju helate sa mnogim metalima kao što su: Bi, Mo, In, Sn,
Sb, Th, Ti i Zr. Osetljivost određivanja raste u priszustvu katjonskih
surfikanata.
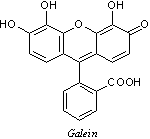
Kalcein (Fluorekson, Fluorescein Komplekson) koristi se kao reagens za određivanje kalcijuma.
Fluoroni (2,3,7–trihidroksi–6–fluoroni) predstavljaju grupu ksantenskih helatirajućih agenasa. Najčešće se koriste fenilfluoron (reagens za Ge i Sn) i metilfluoron (reagens za Sb). Poznatiji su salicilfluoron i disulfofenilfluoron.
Nehelatirajući organski reagensi
Bazne boje
Veliki broj elemenata daje anjonske komplekse sa halidima i drugim ligandima.
Ovi kompleksi mogu formirati jonske asocijate sa baznim bojama, koji se
mogu ekstrahovaati nepolarnim rastvaračima. Bazne boje se generalno koriste
u obliku svojih halidnih soli. Oblik u kome boja može da formira jonski
asocijat je njen jednostruko naelektrisani katjon. Najčešće korišćeni
rastvarači za ekstrakciju su benzen, toluen, hloroform, 1,2–dihloroetan.
Ponekad se dodaje mala količina donorski aktivnog rastvarača koji sadrži
kiseonik da bi se poboljšala ekstrakcija. Kiselost vodene faze može da
varira u širokom opsegu, od umereno koncentrovanih rastvora mineralnih
kiselina (HCl, H2SO4)do pH 3–5, zavisno od upotrebljene boje i ekstakcionog
rastvarača koji se upotrebljava.
Trifenilmetanske boje predstavljaju najveću
grupu. Glavni predstavnici su Malahitno Zeleno, Briliant
Zeleno, Kristalno Violet i Metil Violet.

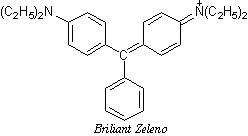
Difenilnaftilmetanske boje su Viktorija
Plavo 4R i Viktorija Plavo B.
Ksantenske bazne boje su Rodamin B,
Rodamin 3B (etil estar Rodamina B), Butil Rodamin B
i Rodamin 6G.
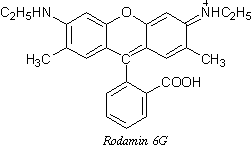
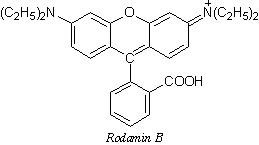
Azinske bazne boje koje se upotrbljavaju u spektrofotometriji su Metilensko Plavo i Metilensko Zeleno. Drugi tipovi boja koji se koriste u spektrofotometriji su antipirinske boje, azo boje i indaminske boje.
Kisele boje
Kisele boje se ne koriste tako često kao bazne boje. Kisele boje formiraju jonske asocijate sa katjonskim metalnim kompleksima. Najčešće se koriste kao kiselinsko–bazni indikatori. Kisele ksantenske boje kao što su Eozin (tetrabromofluorescein), Eritrozin (tetrajodofluorescein) i Bengalsko Roze B. Svi ovi reagensi su dostupni kao natrijumove soli.
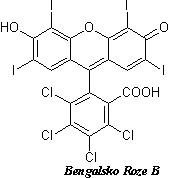
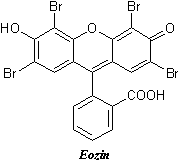
Ditizon
Ditizon (H2Dz, difeniltiokarbazon, 3–merkapto–1,5–difenilformazan) je jedan od najupotrebljavanijih organskih reagenasa. Upotreba ditizona omogućava veoma osetljivo određivanje Pb, Zn, Cd, Ag, Pb, Hg, Cu, Bi i drugih metala. Ditizon se često koristi i kod ekstrativnog odvajanja tragova metala pre njihovog određivanja.
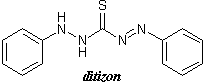
Ditizon je nerastvoran u vodenim rastvorima na pH< 7. Rastvara se u baznim rastvorima, kada se formita narandžast rastvor HDz- anjona. Ditizon se rastvara u CCl4, hloroformu, ugljovodonicima i alkoholima i tada se rastvor boji u zeleno. Dva tautomerna oblika ditizona postoje zajedno u organskim rastvaračima. Mogu se dobiti primarni ili sekundarni* ditizonati, zavisno od toga da li ditizonat reaguje kao anjon monobazne kiseline (HDz-) ili kao dvobazna kiselina (Dz2-). Sekundarni ditizonati formiraju se sa samo nekoliko metala. Oni se predstavljaju sledećim formulama: Ag2Dz, CuDz. Uopšteno, kisela sredina i višak ditizona favorizuju formiranje primarnih ditizona, dok se u baznoj sredini i sa nedovoljnom količinom ditizona formiraju sekundarni ditizonati.
Rastvori metalnih ditizonata u organskim rastvaračima su intenzivno obojeni, njihova boja se razlikuje značajno od boje ditizona. Izuzetak je sivo–zeleni rastvor Pd(HDz)2. Najstabilniji ditizonati ( ditizonati sa Pt, Pd, Au, Ag, Hg i Cu) mogu se ekstrahovati iz jako kiselih rastvora. Neki metali (Bi, In, Zn) mogu se ekstrahovati iz slabo kiselih rastvora, dok se drugi metali (Co, Ni, Pd, Tl, Cd) mogu ekstrahovati iz neutralnih i baznih rastvora. Što je veća količina ditizona, to je niža pH vrednost na kojoj se formiraju ditizonati. pH vrednost na kojoj se individualni metali mogu ekstrahovati je oko 1,5 pH jedinica veća u slučaju kada je ditizon u hloroformu nego u ugljentetrahloridu.
Selektivnost spektrofotometrijskih metoda određivanja metala sa ditizonom postiže se kontrolom kiselosti sredine i korišćenjem maskirajućih agenasa kao što su cijanidi, EDTA, tiosulfati ili jodidi. Najčešće primenjivana metoda za određivanje metala sa ditizonom je ta da se se metal ekstrahuje iz vodenog rastvora sa viškom rastvora ditizona u ugljentetrahloridu. Slobodan ditizon koji se nalazi u nevodenoj fazi se uklanja vodenim rastvorom baze, a zatim se meri apsorbanca obojenog metal ditizonat rastvora.
Atmosferski kiseonik i drugi oksidansi oksiduju ditizon do difeniltiokarbodiazona, koji, za razliku od ditizona, nije rastvoran u vodenom rastvoru baza, ali je rastvoran u CCl4 i hloroformu, kada boji rastvor u braon. U prisustvu surfikanata moguće je odrediti metale direktno u vodenoj fazi bez ekstrakcije.
Reagensi koji su povezani sa ditizonom su: njegov analog di–(2–naftil)tiokarbazon, čiji su CCl4 i hloroformski rastvori plavi; 1,5–difenilkarbazid, koji se koristi za određivanje Cr(IV) i Os; 1,5–difeniltiosemikarbazid i 2,4–difeniltiosemikarbazid koji se koriste za određivanje Ru, Re, Se i Te.
Ditiokarbamati
Natrijum–dietilditiokarbamat (Na–DDCT) se najčešće koristi u spektrofotometrijskoj analizi od svih ditiokarbamata. Metalnhi kompleksi ditiokarmabata su slabo rastvorljivi u vodi, ali se rastvaraju u organskim rastvaračima kao što su CHCl3, CCl4, amil acetat ili aceton. Spektrofotometrijske metode koje se koriste Na–DDCT su prilično neosetljive, zbog toga što boja metalnih kompleksa sa ovim reagensom nije intenzivna. Najintenzivnije su obojeni kompleksi Cu, Bi i Mn sa Na–DDCT. žućkasti kompleks Ag–DDCT koristi se kod određivanja arsena. U reakciji sa metalnim jonima formiraju se neobični četvoromembranski helatni prstenovi. Ugljen tetrahloridom omgu se ekstrahovati kompleksi Bi, Fe, Cu, Ni, Co, Pb; Te; As, Se i MN u pH intervalima 4–11; 4–9; 4–6 i 6–9.Na–DDCT je nestabilan u kiselom rastvoru; raspada se na dietilamin i ugljenik disulfid.
Dietildiamonijum–dietilditiokarbamat se rastvara u hloroformu i stabilan je u kiselom rastvoru, pa je upotrebljavaniji reagens od Na–DDCT. Stabilnost metalnih kompleksa sa ovim reagensom opada u sledećem redosledu: Hd, Ag, Co, Cu, Ni, Bi, Pb, Cd, Fe(III), Zn, Mn. Iskorišćavanjem različitih stabilnosti individualnih metalnih kompleksa sa ovim reagensom, moguće je koristiti hloroformske rastvore manje stabilnih metalnih kompleksa za ekstrakciju metala koji daju stabilnije komplekse.
8–hidroksihinolin
8–hidroksihinolin (Hox, oksin) je amfoterni reagens. Rastvara se u alkalnim rastvorima kao oksinatni anjon, dok se u kiselim rastvorima rastvara u obliku oksinijum katjona. Oksin je rastvoran u hloroformu, benzenu, ugljen tetrahloridu, etanolu, acetonu i drugim organskim reagensima. Sa određenim metalnim jonima oksin formita helate, koji se u većini slučajeva mogu ekstrahovati hloroformom i drugim rastvaračima. U hloroformu, 8–hidroksihinolin ima apsorbcioni maksimum na 315 nm. Rastvori svih metalnih kompleksa sa oksinom su obojeni, a dominira žuta boja. Molarna apsorptivnost oksinata ne prelazi 1·104, tako da su spektrofotometrijske metode određivanja sa ovim reagensom umereno osetljive.
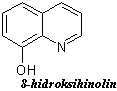
8–hidroksihinolin se često primenjuje za precipitaciju i ekstrakciju velikog broja metala. Selektivnost reakcija metalnih jona sa oksinom poboljšava se maskirajućim agensima kao što su EDTA, tartarati, oksalati ili cijanidi. U kiseloj sredini, sa nekim metalnim jonima (Fe(III), Mo(V), Cr(III)) oksin formira obojene, rastvorne u vodi katjonske komplekse, koji se mogu koristiti za spektrofotometrijsko određivanje tih metala. Organski rastvarači koji sadrže kiseonik mogu ekstrahovati naelektrisani oblik ovog reagensa, u obliku jonskih parova. Neki metali (Ni, Zn, U) mogu formirati anjonske komplekse sa oksinom, koji sa baznim bojama formiraju jonske asocijate, koji se mogu ekstrahovati benzenom.
U spektrofotometriji se upotrebljavaju i derivati 8–hidroksihinolina kao što su: hloro–oksin (5,7–dihloro–8–hidroksihinolin), bromo–oksin (5,7–dibromo–8–hidroksihinolin), feron, 8–merkaptohinolin.
Ostali organski reagensi
Derivati hidroksilamina se koriste za određivanje
samo nekih određenih metala. Najčešće se upotrebljavaju N–benzoil–N–fenilhidroksilamin
(BPHA) i N–fluorofenilhidroksilamin. Ovi reagensi formiraju
helate i koriste se za određivanje sledećih metala: V(V), Mn, Ti, Fe(III)
i Nb.
Hidrazoni se koriste za spektrofotometrijsko
određivanje Ni, Co, Zn, Cd, Cu. Primeri ovih reagenasa su piridin–2–aldehid–2–hinolihidrazon
(PAQH) i kuprizon.
Dioksimi se koriste za određivanje Ni, Pd, Re
i Cu. Predstavnici ove grupe su dimetilglioksim i α–furildioksim.
Formaldioksim je visoko osetljiv reagens za određivanje Mn.
β–diketoni uključuju sledeće reagense: acetilaceton,
tienoiltrifluoroaceton i dibenzoilmetan koji služe za određivanje
U. Fluorovani β–diketoni se koriste za određivanje lantanida.
Tio–Mišlerov keton je veoma koristan reagens
koji omogućava osetljivo određivanje određene grupe metala (Ag, AU, Pd,
Pt, Hg, Cu)
Makrociklična jedinjenja (“crown”
etri i kriptandi)sa svojim hromogenskim grupama kombinuju
prirodnu selektivnost makrociklusa sa mogućnošću direktnog spektrofotometrijskog
određivanja nekih metala (K, Ca). Pikrilaminobenzo–15–kraun–5–kraun–etar
primenjuje se za ekstrakciju i spektrofotometrijsko određivanje kalijuma.
Određivanje se zasniva na ekstrakciji metalnih jonskih asocijata sa ksantenskim
ili sulfoftaleinskim bojama.
Formazanski reagensi su visoko selektivni za
litijum. Upotreba formazana omogućava određivanje litijuma u prisustvu
5000 puta veće količine Na. još jedan reagens iz ove grupe koristi se
za određivanje Li a to je hinizarin.
Prilog 1. Tabela spektrofotometrijskog metoda određivanja pojedinih elemenata sa eksperimentalnim uslovima izvođenja metoda
Element |
Regens |
Eksperimentalni uslovi (pH) |
λmax (nm) |
Prethodna obrada elemnta |
Ag |
Ditizon (0,01% u CCl4) |
EDTA; ekstrak. CCl4 (2–5) |
462 |
|
Tio–Mišlerov keton (0,001M) |
ekstrak. DMF ( |
530 |
||
Al(III) |
Eriohrom Cijan R |
H20 (5,4) |
530 |
precipitacija na pH 4–5 u obliku Al(OH)3; male količine precipitacijom u obliku oksinata |
Aluminol |
H2O (5–6) |
515 |
||
8–hidroksihinolin (1% u hloroformu) |
EDTA, H2O2; ekstrak. hloroform–oksin ( |
390 |
||
Hrom Azurol S |
H2O ( |
545 |
||
As(III) |
Ag–dietil ditiokarbamat |
ekstrak. piridin |
535 |
destilacija As u obliku AsH3 |
Au(III) |
Rodamin B |
0,5–1 M HCl; ekstrak. DIPE |
565 |
|
B |
Kurkumin |
etanol |
550 |
Destilacija B u obliku (CH3)3B |
Karminsko Crveno |
Konc. H2SO4; |
610 |
ekstrakc. B hloroformom |
|
Be(II) |
Hrom Azurol S |
EDTA; (5) |
570 |
|
Eriohrom Cijan R |
EDTA, tartarat; CN-; (9,7) |
525 |
|
|
Bi |
Ditizon |
ekstrak. CH3Cl (0,3–1,2) |
490 |
|
|
Ksilenol Oranž |
H2O (1) |
540 |
|
Ca(II) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Literatura
- Filipović, I. i Lipanović, S., Opća i anorganska kemija, Školska knjiga, Zagreb, 1987.
- Holzbecher, Z.; Diviš, L.; Král, M.; Šucha, L. & Vláčil, F., Organická čindila v anorganické analýze, prev. na rusk., Mir, Moskva, 1979.
- Kaštelan-Macan, M., Kemijska analiza u sustavu kvalitete, Školska knjiga, Zagreb, 2003.
- Luterotti, S., Uvod u kemijsku analizu, 3. izd., Farmaceutsko-biokemijski fakultet, Sveučilište u Zagrebu, Zagreb, 2009.
- Marczenko, Z. & Balcerzak, M., Separation, Preconcetration and Spectrophotometry in Inorganic Analysis, Elsevier, Netherlands, 2000.
- Marjanović–Krajovan, Vj., Organski reagensi u anorganskoj analizi, u: Filipović, I.iSabioncello, P. (ur.), Laboratorijski priručnik, I. dio–Knjiga treća, Tehničkaknjiga, Zagreb, 1965.
- Noller, C. R., Kemija organskih spojeva, Tehnička knjiga, Zagreb, 1967.
- Rondović, D., Kvalitativna hemijska analiza, 3. izd., Naučna knjiga, Beograd, 1991.
preuzmi
seminarski rad u wordu » » »
