OSTALI SEMINARSKI RADOVI
IZ HEMIJE: |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
ATMOSFERA I RADIOAKTIVNOST
Atmosfera je vazdušni omotač Zemlje. Ona štiti Zemlju od štetnog dela Sunčevog zračenja i od udara mateora. Sunce zagreva Zemljinu površinu, a ona zagreva vazduh iznad nje. Nju čini vazduh koji je smesa azota i kiseonika uz dodatak primesa i ostalih gasova. Kiseonik stvaraju biljke i on je neophodan za disanje i ljudima i životinjama. Sve biljke stvaraju kiseonik, pa je tako uskoro stvorena idealna atmosfera za razvoj oblika života koji udišu kiseonik. Atmosfera se proteže oko 3000 km iznad površine Zemlje. Gornja granica nije oštro izražena, zato se gornja granica atmosfere ne može povući. Kaže se da ona postepeno prelazi u kosmičko prostanstvo. Najgušći i najniži sloj atmosfere naziva se troposfera, i u njoj nastaju sve vremenske pojave. Sledeći sloj atmosfera je stratosfera, zatim mezosfera i termosfera. Atmosfera je stalno u promenama. U početku ona se sastojala većinom od ugljen-dioksida.
Radioaktivnost je spontani proces u kojem se atomsko jezgro, emitujući jednu ili više čestica ili kvanata elektromagnetnog zračenja, preobražava u drugo jezgro. Prvobitno nije bila poznata priroda zračenja nego se zbirno govorilo o radijaciji pa je ova pojava „raspada“ jezgra nazvana radioaktivnost, a jezgra koja emituju čestice ili zračenje radioaktivna jezgra ili, ispravnije radioaktivni izotopi. Raspadom početnog jezgra, koje se naziva i jezgro roditelj, nastaje novo jezgro, potomak, koje može da ima redni broj Z i/ili maseni broj A različit od jezgra roditelja. Radioaktivni raspad karakteriše se vrstom i energijom emitovane radijacije i vremenom poluraspada. U prirodi se javljaju alfa-raspad, beta--raspad i gama-raspad. Pri alfa-raspadu radioaktivna jezgra emituju jezgra helijumovih atoma 4He++. Kod beta--raspada, iz jezgra se emituju elektron i antineutrino, a kod gama-raspada jezgro zrači elektromagnetne talase (fotone) velike energije. U laboratoriji mogu da se dobiju i jezgra koja se raspadaju emitujući pozitrone i neutrina (beta+-raspad) ili kod kojih dolazi do K-zahvata.
Nastanak Zemljine atmosfere
O istoriji Zemljine atmosfere pre milijardu godina slabo se zna, ali
sledeće predstavlja verovatan redosled događaja. Kako god bilo to još
uvek ostaje područje istraživanja.
Današnja atmosfera se ponekad odnosi na Zemljinu "treću atmosferu"
kao bi se razlikovao trenutni hemijski sastav od dva značajno različita
prethodna sastava. Prvobitna atmosfera se sastojala od vodonika i helijuma.
Toplina (iz rastaljene kore i sa Sunca) je raspršila atmosferu.
Oko pre 3.5 milijardi godina površina se dovoljno ohladila da se oblikuje
zemljina kora koja se još uvek sastojala od brojnih vulkana koji su ispuštali
paru, ugljen-dioksid i amonijak. To je dovelo do stvaranja "druge
atmosfere" koja je u početku bila sastavljena od ugljen-dioksida
i vodene pare uz nešto azota ali praktično bez kiseonika. (Iako nedavne
simulacije iz 2005. radjene na Univerzitetima u Vaterlou i Koloradu pokazuju
da je mogla imati i do 40% vodonika.) Ta druga atmosfera je imala oko
100 puta više gasa od trenutne atmosfere. Uopšte, veruje se da je efekt
staklene bašte, uzrokovan visokim nivoima ugljen-dioksida, čuvao Zemlju
od smrzavanja.
Tokom sledećih nekoliko milijardi godina vodena para se kondenzovala pa
je stvorila kišu i okeane koji su počeli otapati ugljen-dioksid. Okeani
su apsorbovali približno 50% ugljen-dioksida. Jedna od najranijih vrsta
bakterija bile su cijanobakterije. Fosilni dokaz pokazuje da su te bakterije
postojale pre približno 3.3 milijardi godina i da su bile prvi evoluirajući
fototropni organizmi koji su proizvodili kiseonik. One su odgovorne za
prvu promenu Zemljine atmosfere iz anoksidnog (stanje bez kiseonika) u
oksidno (s kiseonikom) stanje. Kako su cijanobakterije bile prve koje
su započele fotosintezu kiseonika, mogle su promeniti ugljen-dioksid u
kiseonik pa su odigrale glavnu ulogu u oksigenaciji atmosfere. Fotosintetizirajuće
biljke su evoluirale pa su i one počele sve više pretvarati ugljen-dioksid
u kiseonik. Vremenom je višak ugljena postao zatvoren u fosilnim gorivima,
sedimentnim stenama (vapnenac) i životinjskim ljušturama. Kad se kiseonik
oslobodio, reagovao je sa amonijakom i stvorio azot.
Pojavom sve više biljaka nivo kiseonika se značajno povećao (dok se nivo
ugljen-dioksida smanjio). U početku se kiseonik spajao s različitim elementima
(npr. gvožđem) da bi se na kraju akumulirao u atmosferi — rezultujući
masovnim izumiranjem i daljnjom evolucijom. Pojavom ozonskog sloja (ozon
je alotrop kiseonika) životni uslovi su bili bolje zaštićeni od ultraljubičastog
zračenja. Ova atmosfera od kiseonika i azota čini "treću atmosferu".

Slika 1. Pogled na zemljinu atmosferu iz svemira
Hemijski sastav atmosfere
Atmosfera je mehanička mešavina gasova. U donjim delovima atmosfere (do visine od oko 95 km) razmera osnovnih gasova je uglavnom konstantna (stalna). To je bitno zato što se upravo u tom delu atmosfere događaju vremenske promene. Taj sloj atmosfere se naziva homosfera. Iznad tog sloja, u heterosferi, relativni odnosi između pojedinih gasova više nisu stalni. Zbog Sunčevog zračenja i vrlo visokih temperatura u najvišim delovima atmosfere raspadaju se molekuli najvažnijih gasova (azota i kiseonika) pa se pojavljuju njihovi atomi, a u graničnom sloju atmosfere javljaju se atomi helijuma i vodonika.
Permanentni sastavni delovi atmosfere su azot (78,084% od ukupnog volumena homosfere), kiseonik (20,946% od ukupnog volumena homosfere), argon (0,934% od ukupnog volumena homosfere), ugljen -dioksid (CO2; 0,33% od ukupnog volumena homosfere), a u znatno manjoj meri zastupljeni su neon, helijum, metan, kripton, azot-oksid, vodonik, ozon, ksenon, azot-monoksid, jod, radon i dr. Dva glavna hemijska sastojka atmosfere, azot (N2) i kiseonik (O2) čine nešto više od 99% od ukupnog volumena donjih delova atmosfere. Atmosfera koja se sastoji samo od permanentnih sastavnih delova, bez vodene pare i različitih drugih čvrstih i tečnih primesa, naziva se suvi vazduh.
Primese u atmosferi jesu vodena para, razne čvrste i tečne čestice. Njihova količina i volumenski delovi u atmosferi nisu stalni. Čvrste čestice, koje su koloidno raspršene u atmosferi deo su primesa atmosfere, koji se naziva aerosol (lat. aero = vazduh i solvere = rastaviti). Izvori aerosola mogu biti prirodni i veštački (stvara ih čovek). Aerosol može biti organskog i anorganskog porekla.
U prirodnim uslovima atmosfera nije nikada sasvim suva i čista. U atmosferi uvek ima primesa, od kojih je atmosfera mutna i vlažna. Prirodni izvori (jaki pustinjski vetrovi, šumski i stepski požari, vulkanski pepeo i sl.) i umetni izvori (posebno u gradovima i industrijskim regijama) mogu u vazduh emitovati mnoštvo čestica aerosola pa može nastati suva mutnoća.
Azot je inertan gas i nema važniju ulogu u atmosferskim procesima. Međutim, značenje azota je veliko u biološkim procesima. Azot je sastavni do belančevina. U uspotrebi sa drugim hemijskim elementima atmosfere, azot slabo upija Sunčevo zračenje.
Kiseonik je vrlo važan sastojak atmosfere jer bez njega ne može postojati
organski život na Zemlji. Jak je oksidans i lako se spaja sa drugim elementima.
Kiseonik znatno upija Sunčevo zračenje a manjim delom i Zemljino zračenje.
U donjim slojevima atmosfere tokom godine količina kiseonika se vrlo malo
menja. Nešto više ga ima leti nego zimi. Međutim, razlike u količini kiseonika
ne prelaze 0,1% pa te manje promene ne mogu uticati na klimu. Udeo kiseonika
u prirodnim uslovima je stalan i nije ništa veći u šumama ili planinama.
Većih odstupanja može biti tek u zatvorenim prostorima, gdje na povećanu
potrošnju kiseonika utiče disanje ljudi.
Plemeniti gasovi (argon, neon, helijum, kripton i ksenon) jesu inertni pa ne učestvuju u atmosferskim procesima.
Ugljen-dioksid je vrlo značajan hemijski sastojak atmosfere, ali ga prosečno ima samo oko 0,033% (količina varira između 0,02% i 0,05%). Ovaj spoj je značajan za život na Zemlji i za atmosferske procese. CO2 znatno upija Sunčevo kratkotalasno, a posebno Zemljino dugotalasno zračenje pa stim znatno utiče na bilans radijacije, tj. na stanje temperature Zemljine površine i prizemnog sloja vazduha. U atmosferi ga ima više iznad kopna nego iznad mora. Najviše ga ima u gradskim, posebno industrijskim područjima (u zatvorenim prostorijama koncentracija CO2 može porasti i na 0,1 do 0,2%). U dnevnom periodu najviše ugljen-dioksida ima noću (kada nema asimilacije CO2 u biljkama), a u godišnjem periodu najviše ga ima zimi.
Među primesama atmosfere, čija količina za razliku od permanentnih sastojaka nije stalna, posebno značenje ima vodena para (gasovito stanje vode). Voda se u atmosferi javlja i u tekčnom i čvrstom stanju (tzv. hidrometeori). Udeo vodene pare u atmosferi varira od 0% pri vrlo niskim temperaturama (npr. u polarnim krajevima) do 4% pri visokim temperaturama (u tropskim krajevima). Osim od temperature, količina vodene pare zavisi i od udaljenosti od izvora vlage. Količina vodene pare smanjuje se s povećanjem nadmorske visine, npr. u umerenim geografskim širinama pri površini ima oko 1,3% vodene pare (u jedinici obima vazduha), na visini od 1 km udeo opada na 1,01%, na 3 km na oko 0,5%, dok na 8 km visine vodene pare ima svega 0,03%. Vodena para utiče na bilans radijacije, ali i na brojne druge procese u atmosferi (nastanak oblaka, padavina itd.).
Smeša permanentnih sastojaka atmosfere (suvi vazduh) s vodenom parom naziva se vlažni vazduh ili jednostavno vazduh. Vodena para u znatnoj meri upija Sunčevo i Zemljino zračenje. Aerosol, kako je istaknuto, može biti prirodni i veštački, a isto tako može biti organski i neorganski. Prirodne čestice aerosola mogu biti zemaljskog i kosmičkog porekla. Čestice aerosola su vrlo malih dimenzija (od 0,1 um do 20 um). Broj čestica aerosola se smanjuje sa povećanjem visine, ali i udaljavanjem od izvora zagadjenja. Neki posebni geografski uslovi mogu takođe pridoneti povećanju koncentracije čestica aerosola (konkavni reljef, inverzija temperature, ekspozicija prema preovladavajućim vetrovima, koji transportuju čestice aerosola i dr.).
Vertikalna struktura atmosfere
Vertikalna struktura atmosfere je vrlo složena. Obično se po različitim kriterijima atmosfera deli na pojedine sfere. Uz podelu atmosfere na homosferu i heterosferu s obzirom na hemijski sastav, atmosferu je moguće podeliti i u odnosu na termička svojstva pojedinih delova, a isto tako i na osnovu stepena jonizacije tj. električne provodljivosti pojedinih slojeva atmosfere. U geografiji posebno značenje ima podela atmosfere prema temperaturi.
Podela atmosfere prema temperaturi
Zavisno od promjena temperature s visinom atmosferu je moguće podeliti na troposferu, stratosferu, mezosferu, termosferu i egzosferu i na međuslojeve tropopauzu, stratopauzu, mezopauzu i termopauzu.
TROPOSFERA je najniži i najgušći sloj atmosfere, a proteže
se od površine Zemlje do tropopauze. U troposferi je značajna karakteristika
stalan pad temperature sa porastom visine, u proseku 0,65 °C na 100 m
visine. Temperature su na gornjoj granici troposfere vrlo niske (iznad
polova -40 °C, a iznad ekvatora -80 °C). Visina troposfere varira od 7
do 10 km iznad polova, preko 11-14 km iznad umerenih geografskih širina
do 18-20 km iznad ekvatora (dakle, visina raste od polova prema ekvatoru,
i to pored rotacije Zemlje). Na dnevne promene visine troposfere utiču
i regionalne atmosferske prilike; kada je ciklon (područje niskog pritiska)
visina troposfere je manja, a nad anticiklonalnim područjem (s visokim
pritiskom vazduha) visina troposfere je veća. Dnevne razlike u visini
troposfere mogu biti i do nekoliko kilometara. Troposferu je moguće dalje
podeliti na: a) planetarni granični sloj (od Zemljine površine do visine
od 0,5 do 1,5 km). U ovom sloju značajno je delovanje Zemljine površine
na atmosferske procese, pojedini klimatski elementi imaju izraziti dnevni
hod. Posebno je izraženo turbulentno trenje na kretanje vazduha; b) slobodna
troposfera (srednja i gornja) u kojoj je uticaj Zemljine površine na atmosferske
procese manje značajan. S meteorološkog i klimatološkog aspekta troposfera
ima naročito značenje jer je to područje u kojemu se dešavaju gotovo sve
vremenske pojave.
TROPOPAUZA je relativno tanak međusloj između troposfere
i stratosfere. Debljina tropopauze varira od svega nekoliko stotina metara
do nekoliko kilometara. Međutim, troposfera nije kontinuirani sloj oko
Zemlje već je prekinuta (polarna, tropopauza umerenih geografskih širina
i tropska tropopauza). Tropopauza može ponekad potpuno iščeznuti, a nekad
mogu postojati i 2 ili 3 sloja tropopauze. Za razliku od troposfere, u
tropopauzi je promena temperature sa visinom izuzetno mala. U ekvatorskom
području temperatura tropopauze varira između -70 °C i -80 °C, a u umerenim
i polarnim područjima od -40 °C do -60 °C. U tropopauzi su izrazita vododravna
kretanja vazduha, dok su vertikalna kretanja vazduha vrlo slaba. U letnjim
mesecima tropopauza se nalazi na većim, a tokom zimskih meseci na manjim
visinama. U tropopauzi lete savremeni putnički avioni kako bi izbegli
oblake i druge meteorološke neugodnosti, koje mogu ometati ili uzrokovati
nesigurnost vazdušnog saobraćaja.
STRATOSFERA je sloj koji se vertikalno proteže od tropopauze
do visina od 50 do 55 km. Donji deo stratosfere (do približno 30-35 km
visine) naziva se još i hladna stratosfera. U njoj je temperatura niska
i neznatno se menja s porastom visine (ovaj sloj je izoterman). Gornji
sloj stratosfere je topla stratosfera. U toploj stratosferi temperatura
raste sa visinom jer u tom sloju ozon upija ultraljubičasto Sunčevo zračenje.
U gornjim slojevima stratosfere temperatura vazduha raste na oko 0 °C
(± 20 °C). Sa stratosferom se uglavnom podudara
OZONOSFERA. Ozonosfera delom može obuhvatiti i troposferu
i tropopauzu (tzv. troposferski ozon). Najveću koncentraciju ozon postiže
na visinama između 20 i 35 km (stratosferski ozon). Ozon upija oko 4%
Sunčeve energije koja prolazi kroz atmosferu, i to najviše u ultraljubičastom
delu spektra. Ultraljubičasto zračenje ima snažno biološko delovanje (učestvuje
u stvaranju vitamina D, ubija bakterije i sl.). Povećana koncentracija
UV zračenja imala bi negativne posledice na život organizama. Naučnici
misle da je život na Zemlji bio moguć od trenutka kada je Zemlja obavijena
ozonskim omotačem. Ozona ima najviše u proleće, a najmanje u jesen, najmanje
ga ima iznad tropskih, a najviše iznad polarnih područja. Međutim, u XX
veku otkriveno je postojanje ozonskih rupa, koje su upravo najveće u polarnim
područjima (posebno iznad Antarktika). Postojanje ozonskih rupa još nije
dovoljno istraženo pa nije utvrđena ni čovekova uloga. Činjenica je da
neke veštački proizvedene stvari, koje se emitiraju u atmosferu mogu imati
negativne učinke (npr. freon), ali se postavlja pitanje dimenzije čovekovog
uticaja.
STRATOPAUZA je tanak prelazni sloj od stratosfere prema
mezosferi. U stratopauzi su male promene temperature sa visinom.
MEZOSFERA je sloj atmosfere koji se nastavlja na stratopauzu.
Gornja granica mezosfere nalazi se približno na visini od 80 km. Temperatura
vazduha u mezosferi opada sa visinom tako da na gornjoj granici iznosi
-80 °C do -90 °C.
MEZOPAUZA je sloj atmosfere između 80 i 90 km visine
u kome je temperatura vazduha postojana, na oko -90 °C.
TERMOSFERA je sloj koji se nastavlja na mezopauzu, a
dostiže visinu od oko 800 km. U termosferi temperatura vazduha naglo raste;
na 200 km visine već je 900 °C, a na visini od 600 km temperatura vazduha
je 2 000 °C . Izuzetno su velika dnevna kolebanja temperature, čak do
1 000 °C. Visoke vrednosti temperature vazduha u termosferi posledica
su upijanja Sunčevog zračenja u atomima kiseonika, a manje i azota.
TERMOPAUZA je prelazni sloj između termosfere i egzosfere.
EGZOSFERA je spoljni sloj atmosfere, koji se nadovezuje
na termopauzu i gubi se u prostranstvu svemira. Temperatura vazduha je
izuzetno visoka i dostiže vrednosti i do 4000°C. Atomi gasova su u stanju
plazme (plazma je stanje materije kada je ona potpuno jonizirana) i kreću
se haotično. U egzosferi su zarobljene čestice vanzemaljskog porekla i
nastavljaju se kretati u orbiti Zemlje (unutar Zemljinog magnetnog polja).
U egzosferi se nalaze i geostacionirani meteorološki sateliti (do visine
od 36 000 km).
Podela atmosfere prema električnoj provodljivosti
Atmosferu je moguće podeliti prema električnoj provodljivosti, koja zavisi od koncentracije električno nabijenih čestica (jona i elektrona). Jonizacija vazduha posledica je Sunčevog zračenja i kosmičkih zraka. Jonizacija vazduha može nastati i kao posledica radioaktivnog zračenja i električnog pražnjenja. Koncentracija električno nabijenih čestica naglo se povećava od visina 50 km do 60 km pa se taj sloj atmosfere naziva JONOSFERA. Jonosfera se sastoji od nekoliko slojeva (D, E i F sloj) koji imaju veliku praktičnu važnost jer apsorbuju, reflektuju ili propuštaju radio-talase, a od tih svojstava zavisi efikasnost telekomunikacija.
- D - sloj (Kennellyjev sloj) nalazi se između 60 km i 80 km visine. Nastaje zbog upijanja Sunčevog ultraljubičastog zračenja pa je u vezi sa time izraziti dnevni hod: D - sloj slabi i potpuno nestaje preko noći. D - sloj je slabiji od ostalih slojeva jonosfere. Međutim, kako reflektuje druge radio-talase (a upija srednje i kratke) to utiče na čujnost radio stanica koja je tokom dana osetno slabija, a tokom noći je znatno bolja jer D - sloja nema (zato se noću čuju i neke udaljene radio stanice koje se tokom dana ne mogu čuti). U periodima pojačanog Sunčevog zračenja usled pojačane aktivnosti na Suncu (Sunčeve pege; svakih 11 godina) može doći do potpunog prekida prenosa emisija koje emituju radio stanice na srednjim i kratkim radio-talasima.
- E - sloj (Heavysideov sloj) pojavljuje se na visinama od 90 km do 150 km, a nastaje usled upijanja X zračenja. Takođe nestaje noću. Jako reflektuje radio-talase sa izuzetkom UKV (ultrakratkog) područja.
- F - sloj (Appletonov sloj) nalazi se na visinama između 180 i 350 km. Nastaje zbog upijanja UV i X zračenja. U njemu prevladavaju katjoni (pozitivno naelektrisani joni). Kada je Sunčevo zračenje izrazenije (leti, danju) razdvaja se na dva sloja, F1 s manjom i F2 sa većom koncentracijom katjona.
Na velikim visinama, iznad 400 km, kretanja naelektrisanih čestica postaju izraženo naglašena, i to pod znatnim uticajem Zemljinog magnetskog polja (u smeru magnetskih čestica). Iznad 1 000 km visine, u magnetosferi, kretanje jonizovanih čestica je određeno isključivo magnetnim poljem Zemlje. U tom su području izraženi Van Allenovi pojasevi zračenja (unuutrašnji i spoljni) unutar kojih je izražena koncentracija jonizovanih čestica. Taj pojas Zemljinog zračenja debeo je 9 - 12 Zemljinog radijusa (prosečna vrednost Zemljinog radijusa je 6 371 km).U višim geografskim širinama na velikim visinama (iznad 100 km) pojavljuje se polarna svetlost (aurora borealis i aurora australis) kao posledica delovanja Zemljinog magnetskog polja na Sunčev spektar (tzv. korpuskularna energija Sunca; od lat. corpusculum = sitna čestica).
Vertikalna raspodela pritiska i gustine vazduha
Usled dejstva Zemljinog gravitacionog polja, atmosfera vrši pritisak
na Zemljinu površinu. Taj pritisak se definiše kao pritisak koji potiče
od težine atmosferskog stuba po jedinici površine. Neki srednji atmosferski
pritisak mogao bi biti dosta blizu vrednosti od MAgo/4pRE, gde je sa MA
označena ukupna masa atmosfere (5,16- 1018 kg); sa go je označeno srednje
ubrzanje Zemljine teže (9,8 m s-2), dok RE predstavlja srednji poluprečnik
Zemlje (6,37- 106 m). Zamenom ovih numeričkih vrednosti u navedeni izraz
dolazi se do vrednosti od 105 Pa što pedstavlja srednji atmosferski pritisak.
Promena gustine i pritiska je mnogo veća u vertikalnom nego u horizontalnom
pravcu. Do visine od oko 100 km, atmosferski pritisak i gustina se menjaju
u granicama od oko 30% u odnosu na vrednosti unutar standardne atmosfere.
U standardnoj atmosferi pritisak i gustina s visinom opadaju po eksponencijalnom
zakonu tako da za njih približno važe sledeće dve relacije
p(z) = p(0)exp(-z/H) (1.1)
i
p(z) = p(0)exp(-z / H) (1.2)
gde uvedene oznake imaju sledeća značenja: p(z) i r(z) su atmosferski pritisak i gustina na visini z, dok su p(0) i r(0) njihove vrednosti na nivou mora; H je tzv razmer visine. Ovaj razmer ima približnu vrednost od oko 7 km.
Na kraju, slikovitosti radi, istaknimo i sledeće. Dimenzije atmosfere, u odnosu na Zemlju, su male. Ona čini jedan tanak sloj, ali sloj u kome je ispod 500 mb nivoa (kome u prvoj aproksimaciji odgovara visina od 5,5 km) smeštena polovina mase atmosfere, dok je u sloju od 30 km smešteno 99% mase.
Raspodela gasova u atmosferi je uslovljena s dva procesa: molekularnom difuzijom i mešanjem koje je posledica kretanja fluida.
Difuzija uslovljena molekularnim kretanjem teži da obrazuje atmosferu u kojoj bi se srednja molekularna težina smeše gasova postepeno smanjivala do visine na kojoj bi bili prisutni samo gasovi kao što su vodonik i helijum. To praktično znači da se svaka gasna smeša u atmosferi ponaša kao da je ona sama prisutna. Saglasno izrazu (1.2) gustina svakog gasa eksponencijalno opada s visinom ali sa različitim razmerom visine H. Gustina težih gasova opada brže nego što je to slučaj sa lakšim gasovima s razmerom visine koji je obrnuto proporcionalan molekulskoj težini.
Čestice u atmosferi
Čestice u atmosferi su definisane kao svaka čvrsta ili tečna dispergovana materija kod koje su agregati veći od 0,0002 mikrometra a manji od 500 mikrometara u prečniku. Pa zavisno od veličine, čestice prisutne u atmosferi svrstavaju se u dve grupe:
- taložne materije čiji je prečnik čestica veći od 10 mikrometara i
- čestice u suspenziji ( aerosoli ) čiji je prečnik čestica manji od 10 mikrometara.
Brzina taloženja čestica iz atmosfere zavisi od njihove veličine i specifične težine. Brzina taloženja čestica raste sa porastom veličine i specifične težine čestice.
Aerosoli
Aerosoli su sitne čestice u čvrstom (npr. dim) ili tečnom stanju koje
lebde u vazduhu. Reda su veličine od 10 nanometara pa do 100 mikrometara.
Ove dimenzije pokazuju da aerosoli mogu biti veličine nekoliko molekula
pa sve do većih čestica koje vazduh ne može da nosi.
Neke aerosoli nastaju prirodno, potiču od vulkanskih erupcija, peščanih
oluja, šumskih požara, raznih biljaka i morskog rasprskavanja. Ljudske
aktivnosti, kao što je loženje fosilnih
goriva takođe generiše aerosoli. Prosečno gledano Antropogene aerosoili
(aerosoli koje stvori čovek svojim aktivnostima) zauzimaju 10% od ukupne
količine aerosoli u atmosferi.
Tabela 2 daje procenjene količine čestica, sa prečnikom manjim od 2•10–5
m, koje se godišnje emituju u atmosferu.Aerosoli obično imaju neki električni
naboj, a težnja vode da gradi klaster oko naelektrisanih čestica odavno
je poznata.
Tabela 2. Procenjena godišnja količina emitovanih ili nastalih čestica u atmosferi
Izvor čestica |
Količina106 tona/godina |
Prirodni: |
|
Ostaci stena i tla |
100-500 |
Šumski požar |
3-150 |
Morske soli |
300-900 |
Vulkanska aktivnost |
25-150 |
Emisija gasova: |
|
Sulfati iz H2S |
130-200 |
NH4 soli iz NH3 |
80-270 |
Nitrat iz NOX |
60-430 |
Ugljovodonici iz biljaka |
75-200 |
Ukupna prirodna emisija |
773-2800 |
Antropogeni izvori: |
|
Direktna emisija, dim itd. |
10-90 |
Emisija gasova: |
|
Sulfati iz SO2 |
130-200 |
Nitrati iz NOX |
30-35 |
Ugljovodonici |
15-90 |
Antropogeni izvori ukupno |
185-415 |
Ukupno čestice |
958-3215 |
Veličina čestica i hemijski sastav dva su najvažnija parametra pri interakciji aerosola sa okolinom. Depozicija iz atmosfere na tlo, vegetaci- ju i druge površine je funkcija veličine čestica. Stepen do kojeg atmosfer- ske čestice prodiru u ljudsko telo (preko respiratornih organa) određen je uglavnom njihovom veličinom. Samo dovoljno male čestice mogu da ostanu u vazduhu. Procenjuje se da oko 70% čestica koje se unesu u atmosferu ponovo bude staloženo, direktnom depozicijom pod uticajem gravitacionih sila ili sa padavinama, ispiranjem iz atmosfere, odnosno inkorporirani u kapi- ma kao kondenzacioni centri. Brzina taloženja aerosola u najvećoj meri za- visi od njihovih fizičkih osobina (mase, oblika). Podela aerosola na osnovu tih osobina data je u tabeli 3.[5]
Tabela 3. Fizička podela aerosola
Naziv |
Karakteristike |
1. Ejtkenove čestice |
Čestice prečnika manjeg od 0,1 µm |
2. Velike čestice |
Čestice prečnika između 0,1 i 1 µm |
3. Gigantske čestice |
Čestice čiji je prečnik veći od 1 µm |
4. Prašina |
Čestice koje otpadaju sa čvrstih materijala i bivaju ponete vazduhom |
5. Magla i kondenzati |
Čvrste ili tečne materije povučene kondenzovanjem pare |
6. Dim |
Proizvodi sagorevanja izbačeni iz dimnjaka |
Jedinjenja koja se pojavljuju u atmosferi kao zagađivači u vidu aerosoli
Veliki broj jedinjenja, gasova, tečnih i čvrstih čestica se pojavljuju u atmosferi kao zagađivači(polutanti). Uobičajeni polutanti u urbanim sredinama su:
- oksidi sumpora,
- oksidi azota,
- ugljen-monoksid i ugljen-dioksid,
- fotohemijski oksidansi i
- ugljovodonici.
Specifični polutanti se mogu pojaviti emisijom iz raznih industrijskih procesa.To mogu biti:
- teški metali,
- isparljiva organska jedinjenja,
- hlor, fluoridi, azbest, aromatski i hlorisani ugljovodonici i dr.
RADIOAKTIVNOST
Radioaktivnost ili radioaktivno zračenje
je pojava kod pretvaranja atoma da iz njegovog jezgre zrači čestice ili
elektromagnetsko zračenje. Atomska jezgra nisu sva u stanju najniže energije,
ali prirodna osnova jest da one teže, kao i svaki prirodni sastav stanju
niže energije. Pri tome se takva jezgra raspadaju i oslobađaju višak energije
emitovanjem čestica ili fotona koji su kvant elektromagnetskog zračenja.
Kod pretvaranja atoma promatramo protone i neutrone u atomskoj jezgri
i elektrone koji kruže u omotaču kao jednu celinu. Da bismo shvatili pojam
radioaktivnosti moramo poznavati strukturu atoma. Atom, koji
se još naziva i nuklid ima određen broj
protona u jezgri( atomski broj Z koji ujedno u Mendeljejevom periodnom
sistemu hemiskih elemenata označava redni broj ) i određen broj neutrona
N. Neutralni atom koji je električki stabilan u omotaču ima jednak broj
elektrona koliko i protona u jezgri tj. Z broj elektrona. Ako izbrojimo
atomski brojZ i broj neutrona N( A=Z+N ) dobijamo nukleonski
ili maseni broj atoma, pa kažemo da je atom obeležen
s ta dva broja, A kao maseni i Z kao atomski broj. Mogući su slučajevi
da uz isti broj protona u jezgri tj. isti element ima različit broj neutrona,
pa to nazivamo izotopima nekog elementa. Izotopi su elementi
istog atomskog, ali različitog masenog broja. Oni mogu biti stabilni i
nestabilni izotopi. Stabilni izotopi se bez spoljašnje delovanja ne raspadaju,
pa oni nisu radioaktivni, dok nestabilni izotopi se bez spoljašnjeg delovanja
raspadaju sami od sebe, te su oni radioaktivni, tj. zrače radioaktivne
čestice.
U prirodi susrećemo elemente s atomskim brojevima od Z=1( vodik ) do Z=92(
uran ) s dva izuzetka,tehnecij( Z=43 ) i prometij ( Z=61 ) koji se ne
nalaze u prirodi. Dokazano je da svi elementi iznad atomskog broja Z=83
se prirodno raspadaju,što znači da su svi radioaktivni. U prirodi također
nalazimo 81 element s barem jednim stabilnim izotopom, tj. izotopom koji
se vrlo polagano raspada i zanemariv je. Elementi s jednim stabilnim izotopom
su berilij, fluor, aluminij dok ostali ih imaju više,neki čak 10 do 12.
Nestabilni atomi imaju svojstvo da svojim raspadom emituju α-čestice,
β-čestice, γ-čestice( fotone ) i neutrone,pa
se takve emisije nazivaju radioaktivnim zračenjem. Pa krenimo redom, emitovanjem
α-čestica novonastali atom ima za četiri manji maseni broj i za dva manji
atomski broj Z jer se α-čestice sastoje od 2 protona i 2 neutrona što
odgovara jezgri elementa helijuma. Pozitivnog su napona. Posmatranjem
β zračenja vidimo da postoje dve vrste β raspada: β- raspad i β+ raspad.
Kod β- raspada jedan se neutron pretvara u jezgri u proton uz emisiju
elektrona. U takvoj situaciji dobiva se pozitivno ionizirani atom jer
je povećan broj protona, pa se povećava i atomski broj uz nepromijenjen
maseni broj. Kod β+ raspada događa se obratno. Jedan se proton u jezgri
pretvara u neutron uz emisiju pozitrona. Dobivamo negativno ionizirani
atom jer se broj protona smanjio za jedan, pa se smanjuje atomski broj,dok
maseni broj ostaje nepromijenjen. γ zračenje može biti samostalno,a može
biti dio α i β zračenja. Karakteriyujega ga emisija elektromagnetskog
zračenja( fotona ) pri prelazu atomskog jezgra iz jednog kvantnog stanja
u drugo. Emisija neutrona se pojavljuje pri raspadu
teških jezgara.
Pošto je raspad jezgara nestabilnih atoma poprilično slučajna pojava,
teško ju je posmatrati i predvideti kad će se dogoditi. Isto tako na njihov
raspad ne može se uticati nikakvim spoljnim uticajem što povećava problem.
No, međutim statistički podaci pokazuju tačno određenu brzinu i broj jezgara
koje će se raspasti karakteristično za svaki radioaktivni element. Ta
brzina se određuje vremenom poluraspada T koje označava vreme
potrebno da se raspadne polovine jezgra koje su postojale u trenutku početka
posmatranja čime se taj problem sužava.
Istorija otkrića radioaktivnosti
Prirodnu radioaktivnost otkrio je krajem prošlog veka francuski fizičar Anri Bekerel. Trudeći se da ustanovi uzrok fluorescencije odnosno fosforescencije nekih materijala (što je i njegov otac, takođe fizičar, proučavao), Bekerel je na fotografsku ploču umotanu u crni papir postavio kristal uranijumove soli i onda sve izlagao sunčevoj svetlosti. Nakon razvijanja fotografske ploče pokazalo se da je ona bila „osvetljena“, dakle, uranijumova so je emitovala zračenje koje može da prođe kroz crni papir i da dejstvuje na fotografsku ploču. Bekerel je smatrao da uranijumova so zrači pod dejstvom sunčeve svetlosti. A onda, jednog dana, zbog oblačnosti, odustao je od eksperimenta, i foto ploču umotanu u crni papir odložio, a preko nje i unarijumsku so. Posle nekoliko dana ipak je razvio ploču i na veliko iznenađenje, ustanovio da je i ona jako ozračena. Ispravno je zaključio da uranijumova so, bez spoljašnjeg uticaja, dakle spontano, emituje zračenje koje prolazi kroz hartiju i izaziva zacrnjenje foto ploče. Marija Kiri je ovu pojavu nazvala radioaktivnost.


Marija Kiri je zajedno s Pjerom Kirijem proučavala radioaktivnost i drugih uranijumovih jedinjenja, npr. rude pehblende (koja se uglavnom sastoji od uranil oksida U3O8). M. Kiri je utvrdila da je zračenje mnogo jače i da nije proporcionalno količini uranijuma. Pretpostavila je da ruda pehblende sadrži malu količinu nekog elementa koji mnogo jače zrači. Korišćenjem običnih hemijskih postupaka za razdvajanje elemenata, P. i M. Kiri izolovali su polonijum i radijum. Radijum je izolovan posle dugog i strpljivog prerađivanja jedne tone rude pehblende iz koje je već bio izvađen uranijum. Izdvojene su najpre male količine radijuma u obliku radijum-hlorida, a 1910. godine elektrolizom je dobijen i čist radijum. Otprilike u isto vreme M. Kiri i G. Šmit otkrili su, nezavisno, da su i torijumova jedinjenja radioaktivna. Zatim su A. Debijern i F. Gizel u uranijumskim mineralima našli još jedan radioaktivni element - aktinijum. Posle ovih prvih otkrića, sistematskim ispitivanjima, otkriveno je da u prirodi postoji četrdesetak radioaktivnih elemenata.
Osnovne osobine
Radioaktivno zračenje prodire kroz različite materijale, a takođe može i da jonizuje sredinu kroz koju prolazi. Proučavajući prodornu moć zračenja koja emituje uranijum, Raderford je utvrdio da postoje dve vrste zračenja (alfa i beta). Alfa-zračenje lakše se apsorbuje od beta- ali više jonizuje sredinu kroz koju prolazi. Alfa i beta zraci različito skreću u magnetnom polju, na osnovu čega je zaključeno da je reč o česticama suprotnog naelektrisanja i različite mase. Treći oblik prirodne radioaktivnosti (gama-zračenje) otkrio je P. Vilar utvrdivši da ono ne skreće u magnetnom polju, a da se odlikuje izuzetnom prodornošću.
Proces radioaktivnog raspada je egzoterman, dakle praćen oslobađanjem
energije. Energijski bilans radioaktivnog raspada najlakše je odrediti
pomoću Ajnštajnove relacije
za odnos mase i energije
E = mc2
gde je E energija ekvivalentna masi m, a c brzina svetlosti u vakuumu. U skladu sa time energija E koja se oslobađa pri radioaktivnom raspadu jednaka je:
![]()
gde su Mr masa roditelja, Mp masa potomka i Me mase mirovanja emitovanih
čestica. Dakle, oslobođena energija (kinetička i elektromagnetna) jednaka
je razlici u masi između jezgra roditelja i svih proizvoda njegovog raspada.
Jedinica za radioaktivnost u SI sistemu je Bekerel (Bq).
Alfa – raspad
Ispuštanje alfa-čestica, ili jezgra 4He, je proces koji se naziva alfa-raspad. S obzirom da alfa-čestice sadrže protone i neutrone, oni sigurno dolaze od jezgra nekog atoma. Jezgro koje nastaje pri alfa-raspadu će imati drugačiju masu i naelektrisanje od originalnog jezgra. Promena naelektrisanja jezgra znači da je element promenjen u neki drugi element. Maseni broj A nastalog jezgra se smanjuje za četiri, a redni broj za dva u odnosu na početno jezgro. Zbog toga što je maseni broj 4He dva, broj protona u nastalom jezgru se smanji za dva u odnosu na početno jezgro:
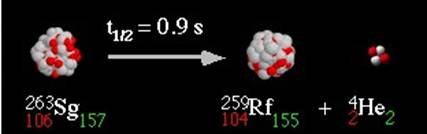
Brzine kojima alfa-čestice izleću iz jezgra mogu da budu veoma velike (i do 107 m/s) a kinetička energija reda veličine nekoliko MeV (mega elektron volti). Prolazeći kroz supstancu, alfa-čestica postepeno gubi energiju dok se na kraju ne zaustavi. Što je veća gustina supstance, to je manji domet alfa-čestica. Domet ove čestice zavisi i od njene početne brzine.
Alfa čestice („alfa zračenje“) koje emituju radioaktivni izotopi predstavljaju jedan od najopasnijih oblika zračenja ako se takvi izotopi nađu u ljudskom telu. Kao i sve teške nelektrisane čestice alfa-čestice u gustoj sredini gube energiju na vrlo malim rastojanjima od izvora. Zbog toga su u biološkim sistemima izuzetno destruktivne. S druge strane, spoljašnje ozračivanje „alfa-zracima“ nije štetno jer čestice kompletno zaustavlja mikrometarski tanak sloj izumrlih ćelija kože kao i nekoliko santimetara vazduha. Međutim, ako se izvor alfa-čestica unese u organizam, udisanjem, gutanjem, injektiranjem ili prodorom kroz kožu (šrapnel, vatreno zrno) on postaje ozbiljna opasnost za ugroženi organizam.
Beta – raspad
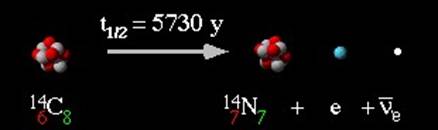
Beta-čestice su negativno naelektrisani elektroni koje emituje jezgro. Kako je masa elektrona samo mali deo atomske mase, masa jezgra koja prolazi kroz beta-raspad se samo malo promeni. Praktično, maseni broj ostaje nepromenjen. Jezgro ne sadrži elektrone. U stvari, beta-raspad nastaje onda kada se neutron menja u proton u okviru jezgra. Svaki beta-rapad prati nevidljivi neutrino. Tada se broj protona, a time i atomski broj menja za jedan. Na primer, ugljenikov izotop 14C je nestabilan i emituje beta-čestice, pri čemu nastaje stabilni azotov izotop 14N:
U stabilnom jezgru, neutron se ne raspada. Slobodni neutron se može raspasti,
emitovanjem alfa- i beta-čestica. Deleći energiju sa beta-česticama nastaje
neutrino. Neutrino je čestica koja postoji samo u kretanju i kreće se
brzinom svetlosti. Neutrino ima malu ili uopšte nema masu, kao ni naelektrisanje,
ali, kao i proton, nosi impuls i energiju. Izvor energije koja se oslobodi
u toku beta-raspada se objašnjava činjenicom da je masa početnog izotopa
veća od sabranih masa produkata raspada. Masa se konvertuje u energiju
baš kao što je Ajnštajn (Einstein) predvideo.
Beta čestice imaju sličan rang energije kao Alfa-čestice, ali imaju manje
naelektrisanje, zato imaju veću prodornost. Tako imaju i štetniji biološki
efekt na čoveka. Za razliku od Alfa-čestica, koje zaustavlja već list
papira, Beta-čestice zaustavlja tek metalna prepreka od nekoliko milimetara.
Gama zračenje
Gama-zračenje obično prati alfa- i beta-zračenje. Gama zraci su vrsta elektromagnetnog zračenja koje rezultuje iz preraspodele naelektrisanja u samom jezgru. Gama-zrak je foton velike energije. Jedina stvar po kojoj se gama-zrak razlikuje of vidljivog fotona, emitovanog iz sijalice, je njegova talasna dužina; talasna dužina gama-zraka je mnogo kraća. Za kompleksna jezgra postoji mnogo načina na koje protoni i neutroni mogu biti postavljeni u samom jezgru.

Gama-zraci se mogu emitovati kada nukleus prolazi kroz promjenu iz jednog oblika u drugi. Na primjer, ovo se može desiti kada oblik jezgra pretrpi promjenu. Kada nukleus emituje gama-zrake ne menja se ni atomski ni maseni broj:
152Dy* ® 152Dy + c
Kada se gama zračenje propušta kroz materiju, verovatnoća za apsorpciju u tankom sloju proporcionalna je debljini tog sloja. Zbog toga u sloju konačnih dimenzija intenzitet zračenja eksponencijalno pada sa debljinom sloja
![]()
Ovde je μ = n×σ apsorpcioni koeficijent meren u cm−1, n broj atoma po cm3 u materijalu, σ apsorpcioni presek u cm2 i d debljina materijala u cm.
Period poluraspada
Vreme koje je potrebno za polovinu atoma, u bilo kojoj datoj količini radioaktivnog izotopa, da se raspadne naziva se period poluraspada tog izotopa. Svaki pojedinačni izotop ima svoje vreme poluraspada. Na primer, period poluraspada izotopa 238U je 4,5 milijardi godina. Tj., za 4,5 milijardi godina, polovina ukupne količine izotopa 238U na Zemlji, će se raspasti na druge elemente. Za sljedećih 4,5 milijardi godina nestaće i druga polovina izotopa 238U. Jedna četvrtina originalne materije će ostati na Zemlji posle 9 milijardi godina. Period poluraspada izotopa 14C je 5730 godina, stoga je ovaj izotop važan za određivanje starosti arheološkog materijala.
Period poluraspada se može prikazati formulom:
N=N0/2
pri čemu je N, broj raspadnutih atoma a N0, broj atoma u početnom trenutku.
Osnovna karakteristika radioaktivnog raspada je tzv. period poluraspada. Period poluraspada je karakteristika svakog hemijskog elementa, tj. izotopa, i on predstavlja potrebno vreme da se raspadne polovina početnog broja jezgara. Za svaki proces radioaktivnog raspada mi nikada ne možemo da znamo kada će se koje jezgro raspasti ali sa sigurnošću znamo da će se za jedan period poluraspada raspasti tačno polovina ukupnog broja jezgara koja su postojala na početku merenja. Periodi poluraspada različitih poznatih elemenata se znatno razlikuju, na primer za uran on iznosi 4,4 milijardi godina dok je za radon taj period 3,825 dana, a postoje i jezgra sa mnogo kraćim periodom poluraspada.
Zračenje (radijacija)
Zračenje je energija koja putuje kroz svemir. Sunčevo zračenje jedno je od najpoznatijih oblika zračenja, koje daje svetlo, toplotu i preplanulost. Sunčevo svetlo sastoji se od zračenja elektromagnetskih talasa iz područja dužih talasnih dužina niskofrekventnog infracrvenog spektra do kraćih talasnih dužina visokofrekventnog ultravioletnog spektra. Iza ultravioletnog spektra nalazi se područje visokoenergetskih zračenja koje se koristi u medicini i koje svi primamo u malim dozama iz svemira, vazduha i sa zemlje. Ova vrsta zračenja naziva se jonizirajuće zračenje. Takvo zračenje može oštetiti materiju, pogotovo živo tkivo. To znači da je takvo zračenje u visokim dozama opasno i zbog toga je potrebno kontrolisati izloženost toj vrsti zračenja.
Elektromagnetski spektar
Živa bića su se razvila i prilagodila okolini u kojem postoji znatan nivo jonizirajućeg zračenja. X-zrake koje se koriste u medicini i stomatologiji pomažu razotkrivanju skrivenih problema. Druga zračenja se koriste za dijagnosticiranje bolesti, a neki se ljudi podvrgavaju zračenju kako bi se izlečili. Svi imamo koristi od velikog broja proizvoda i usluga koji su nam dostupni upravo zahvaljujući pažljivoj upotrebi radioaktivnih materijala.Pozadinsko zračenje je prirodan i neizbježan deo naše okoline. Nivo prirodnog zračenja značajno varira. Ljudi koji žive u granitnim područjima ili na područjima s mineraliziranim peskom prime više prirodnog zračenja iz zemlje nego drugi, dok oni koji žive na velikim visinama primaju više zračenja iz svemira. Većina prirodnog zračenja dolazi od radona, gasa koji nastaje iz zemljine kore i nalazi se u vazduhu koji udišemo.
Jonizirajuće zračenje
Jonizirajuće se zračenje pojavljuje u dva oblika - talasno i čestice, na visokofrekventnom kraju energijskog spektra (1016 Hz i više). Jonizirajuće zračenje prolaskom kroz materiju proizvodi električki nabijene čestice koje se zovu joni. Ovaj se proces naziva jonizacija. Jonizirajuće zračenje obuhvata rendgensko i gama-zračenje te različite vrste snopova atomskih i subatomskih čestica velike brzine. Zajedničko je svojstvo svih vrsta jonizirajućeg zračenja njihovo atomsko i subatomsko porektlo, kao i relativno velika energija koja im omogućuje da vrše jonizaciju. Međutim, način kako do te jonizacije dolazi razlikuje se prema vrsti zračenja.
Jonizirajuće zračenje ima sposobnost uticaja na velike hemijske molekule od kojih su sastavljena sva živa bića te na taj način uzrokuje značajne biološke promene.
Postoji nekoliko vrsta ionizirajućeg zračenja:
X-zrake i gama zrake, kao što je svetlo, predstavljaju energiju koja se prenosi talasima bez pomeranja materijala (npr. toplota i svetlo vatre ili sunca koji putuju kroz prostor). X-zrake i gama zrake su prividno identične, osim što X-zrake ne dolaze iz jezgre atoma. Za razliku od svetla te obe vrste zraka imaju veliku sposobnost prodiranja te mogu proći kroz ljudsko telo. Debele barijere od betona, olova ili vode se koriste kao zaštita od tih zraka.
Alfa čestice imaju pozitivan električni napon i emituju se iz teških elemenata prisutnih u prirodi kao što su uran i radijum, kao i iz nekih veštacko proizvedenih elemenata. Zbog njihove relativno velike veličine te se čestice se lako sudaraju s materijom i brzo gube svoju energiju. One zbog toga imaju malu sposobnost prodiranja te ih je moguće zaustaviti s prvim slojem kože Međutim, ukoliko se unesu u telo, na primer disanjem ili gutanjem, alfa čestice mogu uticati na telesne stanice. Unutar tela, zato što predaju svu svoju energiju na relativno maloj udaljenosti, alfa čestice mogu uzrokovati veće biološke štete od drugih vrsta zračenja.
Beta čestice su brzi elektroni izbačeni iz jezgra atoma. Ove su čestice mnogo manje od alfa čestica i mogu prodreti u vodu ili ljudsko tkivo do dubine od 1 do 2 centimetra. Beta čestice emituju mnogi radioaktivni elementi. Moguće ih je zaustaviti slojem aluminija debljine nekoliko milimetara.
Svemirsko zračenje se sastoji od čestica različitih energija uključujući i protone koji bombardiraju površinu zemlje iz svemira. To je zračenje intenzivnije na većim nadmorskim visinama. Na nivou mora zemljina je atmosfera najgušća i daje najveću zaštitu od svemirskog zračenja.
Neutroni su čestice koje takođe imaju veliku moć prodiranja. Na zemlji, oni uglavnom nastaju cepanjem ili fisijom određenih atoma unutar nuklearnog reaktora. Voda i beton su najčešće korišteni zaštitni omotači za sprečavanje neutronskog zračenja iz jezgre nuklearnog reaktora. Važno je razumeti da jonizirajuće zračenje ne uzrokuje da telo postane radioaktivno.
Međunarodni znak jonizirajućeg zračenja osmišljen je pre pedesetak godina, za interne potrebe, na kalifornijskom Univeryitetu Berkeley u laboratoriji koja se bavila zračenjem. Taj se dizajn, popularno nazvan trolistom (trifoil) izuzetnom brzinom proširio kroz SAD, ali je isprva plava podloga, zamenjena vidljivijom žutom. Kako je znak već bio u širokoj upotrebi, Međunarodna organizacija za standardizaciju imala je lagan zadatak da godine 1975., pod kodom ISO 361-1975(E), standardizuje međunarodni znak jonizirajućeg zračenja (Basic jonizing radiation symbol) kao šest jednakih kružnih isečaka, tri grimizno ljubičasta i tri žuta, s centralnim krugom.
Trefoil (tre od three = tri i foil = list) je naziv i za trolisni
čvor.
Korištenje nuklearne energije
Mnogo ljudi, kada se razgovara o nuklearnoj energiji, misli pritom na nuklearne reaktore (ili možda nuklearno oružje). Tek je nekolicina svesna toga do koje je mere korištenje radioizotopa promenilo naše živote u posljednjih nekoliko decenija.
Korištenjem relativno malih nuklearnih reaktora posebnih namena moguće je dobiti širok spektar radioaktivnih materijala (radioizotopa) po niskoj ceni. Danas, radioaktivni izotopi imaju važnu ulogu u tehnologijama obrade hrane, vode i u zdravstvu.
U medicini, radioizotopi imaju široku primenu u dijagnostici i istraživanjima.
U poljoprivredi i kod održavanja prehrambenih artikala, radioizotopi se koriste za sprečavanje proklijavanja gomoljastih plodova nakon njihova ubiranja, za ubijanje parazita , te za kontrolu zrenja uskladištenog voća i povrća.
Kod uzgoja poljoprivrednih kultura i stoke, radioizotopi takođe igraju važnu ulogu. Oni se koriste za proizvodnju rayličitih poljoprivrednih kultura otpornih na bolesti i vremenske uslove, za proučavanje delovanja vestačkih đubriva i insekticida, te za poboljšanje produktivnosti i zdravlja domaćih životinja.
U industriji i u rudarstvu radioizotopi se koriste za ispitivanje varova, za detekciju lomova, za proučavanje brzine trošenja materijala, te za analizu širokog spektra minerala i goriva. Postoji i mnogo drugih načina njihove upotrebe. Radioizotopi dobijeni od plutonijuma, formiranog u nuklearnim reaktorima, koriste se u većini kućnih detektora dima.
U nuklearnom reaktoru uransko je gorivo složeno na način koji omogućuje kontrolisanu fisijsku lančanu reakciju. Toplota koja nastaje deljenjem (cepanjem) atoma U-235 koristi se za dobijanje pare s kojom se pokreću turbina i generator i proizvodi električna energija.
Preko 400 malih nuklearnih reaktora pokreće oko 250 brodova, većinom podmornica, u rasponu od ledolomaca do nosača aviona. Takva plovila mogu boraviti na moru duže vreme bez potrebe za ponovnim punjenjem goriva.
Toplota koja nastaje radom nuklearnih reaktora može se takođe koristiti direktno, a ne samo za proizvodnju električne energije. U Švedskoj i Rusiji, na primer, koristi se za grejanje u zgradama, te kao izvor toplote u različitim industrijskim procesima (na primer desalinizacija vode).
Izvori zračenja i njihova primjena
Izvori zračenja mogu biti prirodni i veštački. U prirodne spadaju kozmičko
zračenje i zračenje iz Zemlje. Kozmičko zračenje dolazi iz Svemira, delomično
se apsorbuje u atmosferi te dolazi do Zemlje. Sadrži čestice raznih energija
te ima neutronsku komponentu, koja daje brzinu doze do 25 mSv/godinu,
te direktno jonizirajuću komponentu od 0,25 do 0,30 mSv/godinu. Intenzitet
zračenja zavisi od geografske širine, pa je veći prema polovima, te raste
s nadmorskom visinom. Zračenje iz Zemlje potiče iz materijala u stenama
kao što su izotopi kalijuma i rubidijuma te dve porodice radioaktivnih
elemenata koje nastaju raspadom urana i torijuma. Godišnja doza prirodnog
zračenja, uzevši u obzir kozmičko i zemljino zračenja, na nivou mora iznosi
za granit 1,43 mSv/godinu, a za sedimentnu stenu 0,76 mSv/godinu.
Uz ove prirodne izvore čovek je proizveo i niz veštačkih izvora zračenja,
bilo da se radi o aparatima koji proizvode različita zračenja, ili se
radi o radioaktivnim hemikalijama. Ovakvi se izvori koriste u atomskim
centralama kao izvor energije, u industriji za kontrolu kvalitete materijala,
u prehrani za sterilizaciju hrane, te u širokom spektru medicinskih zahvata
od sterilizacije pribora pa do uništavanja tumorskog tkiva. Upotreba ovih
veštačkih izvora zračenja znatno povećava doze zračenja koje prima pojedinac,
ali i čovečanstvo, odnosno živi svet kao celina. Najviše se zračenja prima
prilikom raznih radiografskih snimanja, pa se preduzimaju mere kako bi
se ona svelo na razumne mere, te maksimalno zaštitilo one koji rade s
ovakvim izvorima zračenja. Stoga i postoje stroge zdravstvene kontrole
i svaki od radnika koji radi s izvorima zračenja mora nositi dozimetar
koji očitava ukupnu dozu zračenja primljenu kroz određeno razdoblje. Osim
toga mere se i zagađenja radioaktivnošću u prostorijama gde se ovakvi
izvori primjenjuju. Tako za profesionalce koji rade s izvorima zračenja,
efektivna doza na celo telo može biti do 20 mSv godišnje tokom uzastopnih
pet godina, odnosno eventualno ponekad i više ali maksimalno do ukupno
5x20mSv. Za učenike od 16 do 18 godina koji se pripremaju za rad s izvorima
zračenja, doza na celo telo je ograničena na 6 mSv godišnje, dok je za
ostalo stanovništvo ona do 1 mSv godišnje. Može biti i do 5 mSv tokom
jedne godine, ali uz uslov da zadovolji kriterijume da u pet uzastopnih
godina ne pređe ukupno 5 mSv
Prirodno radioaktivno zračenje zemlje
Kolika količina radioaktivnosti se nalazi u jednom kvadratnom kilometru, do jednog metra dubine? Sledeća tabela prikazuje aktivnosti nekih od nuklida za takav volumen (oko 7,894 x 105 m3). Nivo aktivnosti varira u zavisnosti o tipu tla, količini minerala, te gustine (~1,58 g/cm3). U tabeli su pretstavljene standardne vrednosti tih parametara.
Prirodna radioaktivnost km2 (1 metar dubine) |
|||
Nuklid |
Aktivnost korištena za izračunavanje |
Masa nuklida |
Aktivnost |
Uran |
0.7 pCi/gm (25 Bq/kg) |
2,200 kg |
0.8 Ci (31 GBq) |
Torij |
1.1 pCi/g (40 Bq/kg) |
12,000 kg |
1.4 Ci (52 GBq) |
Kalij 40 |
11 pCi/g (400 Bq/kg) |
2000 kg |
13 Ci (500 GBq) |
Radijum |
1.3 pCi/g (48 Bq/kg) |
1.7 g |
1.7 Ci (63 GBq) |
Radon |
0.17 pCi/gm (10 kBq/m3) |
11 µg |
0.2 Ci (7.4 GBq) |
Područja jačeg prirodnog zračenja
Zračenje prirodnog porekla je rezultat kombinacije kozmičkog zračenja
(fotoni, mioni, itd.) i zračenja elemenata koji se nalaze na (u) zemlji
(40K, 232Th, 226Ra, itd.). Nivo zračenja širom sveta iznosi 8 – 15 µrad/h.
No postoje neka područja na Zemlji gde je prirodno zračenje (bez čovekovog
uticaja) mnogo veće u odnosu na ostale delove Zemlje. Najveće nivo zračenja
otkrivene su u Brazilu, Indiji i Kini. Veliki nivo zračenja je uzrokovan
visokim koncentracijama radioaktivnih materijala u tlu. Jedan od tih materijala
je monacit, nerastopivi retki mineral koji se nalazi u morskom pesku.
U pesku se također nalazi u monacit i mineral ilmenit, koji pesku daje
karakterističnu crnkastu boju. Najvažniji radionuklidi u monacitu su grupe
232Th, te uranovi potomci kao npr. 226Ra.
U Brazilu se monacit nalazi u pesku na morskim plažama. Zračenje takvog
peska iznosi i do 5 mrad/hr (50 µGy/hr), što je oko 400 puta veće od normalnog
nivo zračenja. Neke od glavnih ulica obližnjih gradova imaju nivo zračenja
oko 0.13 mrad/hr (1.3 µGy/hr), što je 10 puta veće nego u normalnom čovekovom
okruženju u drugim delovima sveta..
Na jugozapadnoj obali Indije kolicina monacita je veće nego u Brazilu.
U proseku je zračenje slično kao u Brazilu, 500-600 mrad/yr (5 - 6 mGy/yr),
ali su zabeleženi slučajevi kada se na nekim lokacijama izmerilo zračenje
od 3260 mrad/yr (32.6 mGy/yr).
U Kini postoji područje gde zračenje iznosi oko 300-400 mrad/yr (3-4 mGy/yr).
Uzrok je takođe monacit koji sadrži torijum, uran i radijum.
Prirodna radioaktivnost oceana
Sva voda na Zemlji, uključujući mora i okeane, sadrži radionuklide. Zapremina okeana je sledeća:
- Pacifik = 6.549 x 1017 m3
- Atlantik = 3.095 x 1017 m3
- Ukupno = 1.3 x 1018 m3
U tabeli su prikazani neki nuklidi koje možemo naći u morima, te njihova aktivnost.
Prirodna radioaktivnost oceana |
||||
Nuklid |
Aktivnost korištena za izračunavanje |
Ocean |
||
Pacifik |
Atlantik |
Ukupno |
||
Uran |
0.9 pCi/L |
6 x 108 Ci |
3 x 108 Ci |
1.1 x 109 Ci |
Kalijum 40 |
300 pCi/L |
2 x 1011 Ci |
9 x 1010 Ci |
3.8 x 1011 Ci |
Tricijum |
0.016 pCi/L |
1 x 107 Ci |
5 x 106 Ci |
2 x 107 Ci |
Ugljenik 14 |
0.135 pCi/L |
8 x 107 Ci |
4 x 107 Ci |
1.8 x 108 Ci |
Rubidijum 87 |
28 pCi/L |
1.9 x 1010 Ci |
9 x 109 Ci |
3.6 x 1010 Ci |
Kozmičko zračenje
Kozmičko zračenje je zračenje koje nam dolazi iz Svemira. Zračenje svemira u interakciji sa našom atmosferom proizvodi kozmogeničke radionuklide. Kozmičko zračenje se može podeliti na dve vrste: primarno i sekundarno. Primarno kozmičko zračenje čine ekstremno visokoenergetske čestice (do 1018 eV), koje su najčešće protoni te ponekad neke veće čestice. Najveći deo njih dolazi izvan Sunčevog sistema. Neka primarna kozmička zračenja potiču i od našeg Sunca.
Mali deo primarnog kozmičkog zračenja prodire do površine Zemlje, a veći deo uz delovanje atmosfere menja svoja svojstva. Međudelovanjem kozmičkog zračenja i atmosfere nastaje sekundarno niskoenergetsko kozmičko zračenje, koje čine čestice kao što su fotoni, elektroni, neutroni i mioni.
Atmosfera i Zemljino magnetno polje deluju kao štit od kozmičkog zračenja smanjujući mu energiju. Što je deblji atmosferski sloj između nas i izvora kozmičkog zračenja, to će manja količina zračenja doći do nas. To znači da količina kozmičkog zračenja zavisi od nadmorske visine. Stanovnik SAD-a u proseku primi dozu od 27 mrem-a kozmičkog zračenja godišnje. Ta doza se udvostručuje svakih 2 km penjući se u visinu.
Tipične doze ozračivanja kozmičkim zračenjem su:
- 4 µR/hr na severoistoku SAD-a
- 20 µR/hr na 5 km
- 300 µR/hr na 16 km
Razlika zračenja na ekvatoru je za oko 10% veća nego na polovima. Na visini od 15 km zračenje raste za 75%.
Vožnja avionom povećava godišnju dozu ozračenosti za nekoliko mrem-a, naravno zavisno o tome koliko se često vozimo avionom, na kojoj visini letimo te koliko dugo let traje.
Doze zračenja koju primi čovjek za vreme leta avionom, za brzine ispod i iznad brzine zvuka, u normalnim vremenskim uslovima |
||||||
Putovanje |
Sporije od brzine zvuka |
Nadzvučna brzina |
||||
Trajanje leta (sati) |
Doza po putovanju |
Trajanje leta (sati)) |
Doza po putovanju |
|||
(mrad) |
(µGy) |
(mrad) |
(µGy) |
|||
Los Angeles-Paris |
11.1 |
4.8 |
48 |
3.8 |
3.7 |
37 |
Chicago-Paris |
8.3 |
3.6 |
36 |
2.8 |
2.6 |
26 |
New York-Paris |
7.4 |
3.1 |
31 |
2.6 |
2.4 |
24 |
New York-London |
7.0 |
2.9 |
29 |
2.4 |
2.2 |
22 |
Los Angeles-New York |
5.2 |
1.9 |
19 |
1.9 |
1.3 |
13 |
Sydney-Acapulco |
17.4 |
4.4 |
44 |
6.2 |
2.1 |
21 |
Zračenje ljudskog tijela
Čovek je izgrađen od hemijskih elemenata, i nije iznenađujuće što su neki od njih radionuklidi. Oni takođe cirkulišu kroz naše telo, jer se hranimo, pijemo tečnost i dišemo, a radionuklidi se nalaze svuda oko nas. U tabeli su navedeni neki od nuklida koji sačinjavaju ljudsko telo, te njihova količina i aktivnost. Takođe su navedene uobičajene dnevne količine unosa u telo dotičnog nuklida.
Prirodna radioaktivnost u ljudskom telu |
|||
Nuklid |
Ukupna masa nuklida u telu |
Ukupna aktivnost nuklida u telu |
Dnevni unos nuklida |
Uran |
90 µg |
30 pCi (1.1 Bq) |
1.9 µg |
Torijum |
30 µg |
3 pCi (0.11 Bq) |
3 µg |
Kalijun 40 |
17 mg |
120 nCi (4.4 kBq) |
0.39 mg |
Radijum |
31 pg |
30 pCi (1.1 Bq) |
2.3 pg |
Ugljenik 14 |
95 µg |
0.4 µCi (15 kBq) |
1.8 µg |
Tricijum |
0.06 pg |
0.6 nCi (23 Bq) |
0.003 pg |
Polonijum |
0.2 pg |
1 nCi (37 Bq) |
~0.6 µg |
Razumno je pretpostaviti da svi nuklidi koji se nalaze u našoj bližoj
okolini postoje i u našem telu u barem malenim količinama.
Zaštita od radioaktivnosti
Uticaj zračenja na čoveka
Biološke učinke zračenja možemo podijeliti u dvije grupe. Jedni su deterministički (nestohatički), a drugi su stohastički učinci. Deterministički su učinci posledica gubitka velikog broja stanica i nastaju primjenom velikih doza zračenja i vidljivi su brzo nakon ozračenja. Da bi učinak bio vidljiv potrebna je određena količina ("prag") zračenja. Stohastički učinci, kao što su mutacije, nasledne promene, te tumori vidljivi su tek nakon određenog vremena latencije, za njih nema prag, tj. može ih izazvati i veoma mala doza zračenja. Stoga ih se niti ne može predvideti, kao što se to može učiniti za tačno određeni - deterministički učinak, nego ih se može statistički predvideti. Stohastički učinci mogu nastati u somatskim ali i u spolnim stanicama, pa se promene mogu preneti na potomstvo (nasledne promene, indukcija leukemija, mentalna retardacija, malformacije, smrt ploda). Zračenje može izazvati čitav spektar naslednih promena koje mogu biti veoma male, poput promene pojedinom genu, veće, poput onih nastalih lomovima hromosoma i spajanjem preostalih delova, do veoma opsežnih kada se menja i broj hromosoma. Jasno je da će i biološke posledice biti to teže što su promene genoma opsežnije, a veoma velike promjene, usled odumiranja stanica, tkiva, te organa, nespojive su sa životom jedinke.
Treba uočiti da učinci zračenja ne zavise samo od apsorbiranoj dozi zračenja, koja je odnos predane energije zračenja i mase tkiva (jedinica je Gray -Gy), nego i od vrste zračenja i od ozračenoj stvari. Znači da će jednaka apsorbirana doza različitih vrsta zračenja izazvati i različite biološke učinke pa se govori o ekvivalentnoj dozi zračenja. Ona osim apsorpcije energije po masi tkiva vodi računa i o vrsti zračenja i o distribuciji energije u tkivu, što omogući direktno upoređivanje učinaka raznih vrsta zračenja u raznim tkivima, a jedinica ekvivalentne doze je J/g i to je 1 Sv (Sievert).
Uz mutacije, navedene potencijalne maligne promene, u kasne posledice zračenja spadaju zamućenje očna sočiva, degenerativne promene u plućima, oštećenja bubrega (glomerulonefritis), te skraćenje životnog veka, zbog navedenih ali i drugih razloga. Smrt jedinke nastane radi teških, nepopravljivih oštećenja tkiva i organa. Ako je čovjek po celom telu primio dozu veću od 2 Gy, te ako nije usledila adekvatna pomoć, uslediće će smrt. Znatno veće doze, 100 Gy ili veće, oštećuju mozak i krvne sudove te smrt usledi nekoliko minuta nakon zračenja, pa i tokom zračenja, a može uslediti i unutar 48 sati od incidenta. Doze od 10 do 100 Gy oštete probavni trak, pa uslijedi veliki gubitak tečnosti i elektrolita, a nastanu i infekcije, pa smrt usledi nakon 3 do 5 dana, ukoliko nije usledila odgovarajuća intervencija (davanje infucija, presađivanje koštane srži) Doze od 2 do 10 Gy oštete najviše krvotvorno tkivo. U cirkulaciji postupno nestaju krvne stanice pa je smanjena koagulabilnost krvi (nema trombocita), povećana osetljivost na infekcije (nema leukocita), a manjak eritrocita otežavadolayak kiseonika do tkiva. Smrt nastupa unutar 10 do 30 dana ukoliko se nije intervenisalo (presađivanje koštane srži). Za mogući oporavak, ukoliko je lečenje odgovarajuće, treba do potpunog oporavka proći i nekoliko godina. Naveden su granice okvirne, temeljene pretežno na rezultatima dobijenim na eksperimentalnim životinjama, te nakon pojedinih incidenata kada su ljudi, najčešće radi grešaka na reaktorima, bili izloženi zračenju.
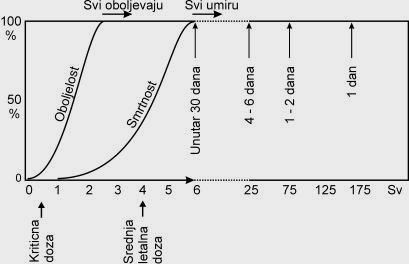
Slika: Uticaj ekvivalentne doze zračenja na čoveka.
Zaključak
Kao sto smo naveli u prethodnom tekstu, planeta Zemlja je skoro savršena lopta koja se kreće oko Sunca. Ona je obavijena gasovitim omotačem zvanim atmosfera. Formirala se pre mnogo milijardi godina. Štiti nas od Sunca i sadrži vazduh koji udišemo. Bez nje ne bi bilo života. U njoj se dešavaju mnogi procesi i pojave koji su od izuzetnog značaja za život na Zemlji - zagrevanje i hlađenje vazduha, vetrovi, stvaranje oblaka, padavine...
Sve je veće zagadjivanje atmosfere sto dovodi do trajnih posledica po ljude i zivi svet na našoj planeti.
Nedavna nuklearna kriza u Japanu umnožila je našu zabrinutost zbog opasnosti od posledica koje radioaktivnost može izazvati u opštim svetskim okvirima. Dovoljno je upznati se sa černobiljskom i japanskom katastrofom, i zaključiti kako smo nezaštićeni od posledica nuklearne katastrofe. Samo jedan scenarijo sličan onome u Japanu biće dovoljan da se zauvek promeni život u Evropi.
Osim sto će milijoni ljudi osetiti posledice nedavne japanske katastrofe, ona nas je podsetila kako je naša planeta mala i kako je sve povezano. Svojim glasom protiv bezciljnog insistiranja na neophodnost nuklearne energije moyemo dati vise sigurnosti životu budućih generacija i usmeriti brod ljudskog roda u pametnijem smeru.
LITERATURA
- Udžbenik fizičke hemije, dr Samjuel Gleston, savetnik komisije za atomsku energiju SAD, Naučna knjiga, Beograd, 1967.
- Aleksandar R. Raković, „Zagađenje i prečišćavanje vazduha“, Gradska knjiga, Beograd 1981
- Hemija atmosfere, Dr Jovan Djuković, GLAS, Beograd, 1984.
- http://www.orau.com/ptp/museumdirectory.html
- http://www.crpa-acrp.ca/
preuzmi
seminarski rad u wordu » » »

