OSTALI SEMINARSKI RADOVI
IZ HEMIJE: |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
Dobijanje metanola, sirćetne kiseline iz metanola, proizvodnja etilen-glikola iz etena, proizvodnja vinilhlorida iz etena
Dobijanje metanola
Metanol se dobija konverzijom sintetskog gasa.
CO + 2 H2 CH3OH ∆ H = – 92 kJ/mol
Ukoliko se sinteza odvija pomoću sintetskog gasa dobivenog iz metana onda
je nepovoljan odnos između vodonika i CO (3 : 1) pa se to kompenzuje dodatkom
ugljen-dioksida koji reaguje sa vodonikom:
CO2 + 3 H2 CH3OH + H2O ∆ H = - 50 kJ/mol
Iz prethodnih reakcija vidi se da se ravnoteža ovih reakcija pomera ka
metanolu na nižim temperaturama i povišenom pritisku. Kao katalizator
u ovoj reakciji ranije se koristila smeša cink-oksida i hrom(III)-oksida.
Maksimalna aktivnost katalizatora se postiže kada je odnos Zn/Cr 70 :
30. Katalizatori su rezistentni na uobičajene otrove tako da im je radni
vek nekoliko godina. Reakcija se izvodi na 320 do 380 ° C i pritisku od
340 bara. S obzirom na to da je reakcija egzotermna ravnoteža se pomera
uvođenjem hladne smeše gasova na različitim nivoima u reaktoru.
Visoki pritisak i temperatura poskupljuju proizvodnju te je stoga razvijen novi postupak koji kao katalizator koristi aktivniji katalizator na bazi bakra. Koriste se u zavisnosti od proizvođaća smese CuO-ZnO-Cr2O3 ili CuO-ZnO-Al2O3. Ovi katalizatori omogućavaju izvođenje reakcije na temperaturama oko 240 ° C i pritisku od 50 do 150 bara. Ovi katalizatori daju veću čistoću metanola (99,99 %). Po izlasku iz reaktora proizvodi reakcije se hlade na 40 ° C pri čemu metanol kondenzuje a neizreagovali gasovi se mešaju sa svežim sintetskim gasom. Metanol se dalje prečišćava frakcionom destilacijom.
U cilju poboljšanja procesa razvijeni su novi tipovi reaktora.
tubularni reaktor kod koga gas zagrejan na 140 ° C prolazi kroz cevi i zagreva se toplotom koja se oslobađa u reaktoru. Na taj način ovaj reaktor se ponaša kao interni izmenjivač toplote.
Linde izotermalni reaktor kod koga se oslobođena toplota troši za generisanje pare u spiralno namotanom izmenjivaču toplote. Katalizator se nalazi na omotaču reaktora.
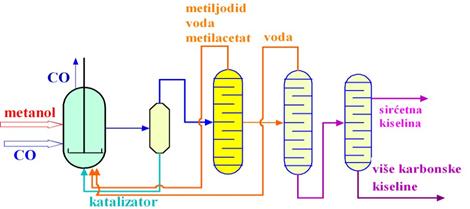
2. Dobijanje sirćetne kiseline iz metanola
Šezdesetih godina razvijen je postupak za sintezu sirćetne kiseline iz
metanola reakcijom karbonilovanja u prisustvu CoI2. Reakcija se izvodi
na 250 ° C na pritisku od 680 bara.
2 CoI2 + 3H2O + 11CO 2HCo(CO)4 + 4HI + 3 CO2
HI + CH3OH CH3I
CH3I + HCo(CO)4 CH3Co(CO)4 + HI
CH3Co(CO)4 + CO CH3COCo(CO)4
CH3COCo(CO)4 + H2O CH3COOH + HCo(CO)4
Kao što se vidi iz prethodnih reakcija i kobalt i jodid se potpuno regenerišu.
Nakon pet frakcionih destilacija dobija se glacijalna sirćetna kiselina
(99,8%). Uvođenjem Monsanto postupka ovaj postupak je izgubio na značaju.
Monsanto postupak kao katalizator koristi rodijum-karbonil-jodid. Prednosti
ovoga postupka prikazane su u tabeli:
|
kobalt |
rodijum |
količina |
10-1 |
10-3 |
temperatura |
230 |
180 |
pritisak (atm) |
500 do 700 |
30 do 40 |
selektivnost |
90 % |
99 % |
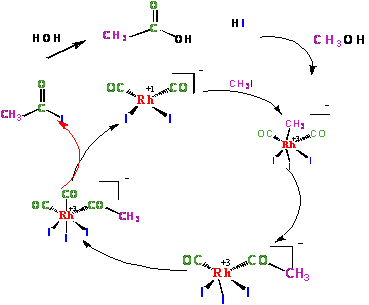
Pored reakcije sa metil-jodidom kompleks rodijuma može da reaguje i sa
HI pri čemu nastaje kompleks rodijuma (III) koji ukoliko je nizak pritisak
CO može da nagradi slabo rastvorni RhI3. Ovo se prevazilazi izvođenjem
reakcije u visokoj koncentraciji vode koja razlaže nastali kompleks.
[Rh(CO)2I2]- + 2HI → [Rh(CO)2I4]- + H2
[Rh(CO)2I4]- + H2O + CO → [Rh(CO)2I2]- + 2HI + CO2
 S
obzirom da visoka koncentracija vode uzrokuje sporedne reakcije postupak
je modifikovan dodatkom LiI koji povećava rastvorljivost RhI3.
S
obzirom da visoka koncentracija vode uzrokuje sporedne reakcije postupak
je modifikovan dodatkom LiI koji povećava rastvorljivost RhI3.
Interesantna je modifikacija ovoga postupka koja kao sirovinu koristi
metil-acetat pri čemu kao proizvod nastaje acetanhidrid. Ovaj postupak
razvila je firma Eastman Chemical koja je iskoristila činjenicu da ovo
nije bilo zaštićeno patentom i na tome zaradila veliki novac.
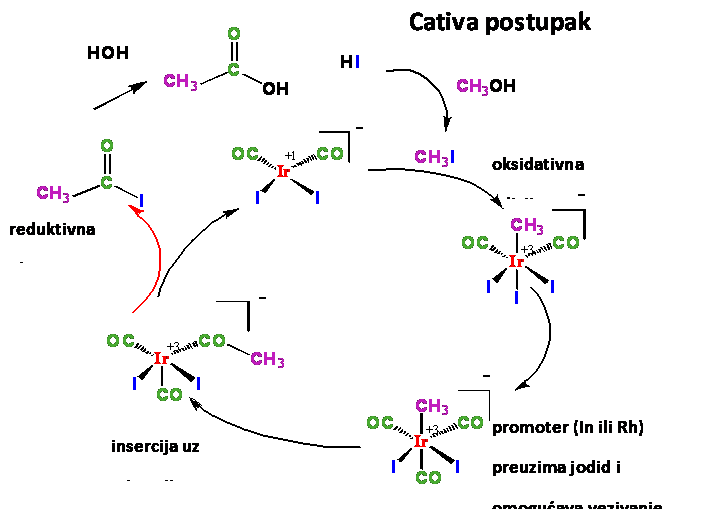
Prednosti Cativa postupka su:
- niža cena iridijuma
- veća selektivnost
- manja koncentracija katalizatora
- veća rastvorljivost nego kod rodijuma samim tim manja količina vode
- veći broj ciklusa koji mogu da se izvedu sa katalizatorom
- fabrike sa Monsanto postupka vrlo lako mogu da pređu na Cativa postupak
3. Proizvodnja etilen-glikola iz etena
Danas se dobijanje etilen-oksida bazira isključivo na direktnoj oksidaciji etena u prisustvu srebra kao katalizatora. Kiseonik se aktivira na površini srebra i u molekulskom obliku reaguje sa etenom. Preostali atomski kiseonik se ne može dalje adirati već se troši na oksidaciju etena. Iz mehanizma se vidi da oko 65 do 75 % etena prelazi u etilen-oksid.
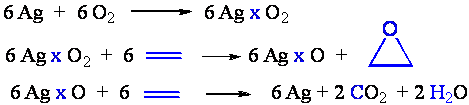
Osnovni problem u industrijskom postupku dobijanja etilen-oksida je egzotermnost reakcija epoksidacije i oksidacije etena što uzrokuje oslobađanje velike količine toplote. Pregrevanje može izazvati dezaktivaciju katalizatora. Koriste se tubularni reaktori pri čemu se kao izmenjivači toplote koriste ključali kerozin ili tetralin. Toplota koja se oslobađa se koristi za generisanje vodene pare. Stepen konverzije pri prolasku kroz katalizator je oko 10 %. Danas je u novim postrojenjima vazduh zamenjen kiseonikom. Ovo je omogućilo da se CO2 koji je ranije odlazio kao otpadni gas sada trapuje u vrućem rastvoru kalijum-karbonata.
Tipični uslovi u reaktoru su pritisak 10 do 30 bara i temperatura između 250 i 300 ° C. Katalizator je srebro koje je naneto na odgovarajućem nosaču. Obrada reakcionih gasova obuhvata ispiranje etilen-oksida sa vodom. Nakon toga se etilen-oksid isteruje iz vode pomoću vodene pare i frakcioniše u destilacionoj koloni. Voda delimično prevodi etilen-oksid u etilen-glikol.
Dodatak kokatalizatora (Rb/Cs) povećava selektivnost na 94 %.
Proizvodnja etilen-glikola
Najveći udeo ima postupak koji se zasniva na reakciji etilen-oksida sa vodom. Trenutno su u opticaju dva postupka. Kiselo katalizovani postupak i nekatalitički postupak. U oba postupka koristi se desetostruki višak vode a postupci se razlikuju po uslovima reakcije:
- katalitički – 0,5 do 1 % H2SO4, normalni pritisak i 50 do 70 ° C
- nekatalitički pritisak od 20 do 40 bara i temp. 140 do 230 ° C
Selektivnost reakcije u nastajanju etilen-glikola je oko 90 %. Ostatak
čine di-, tri- i polietilen-glikoli.
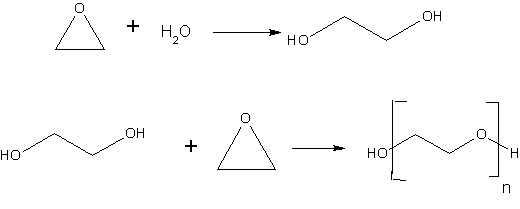
Etilen-glikol se koristi kao antifriz i kao sirovina za sintezu poliestara (polietilen-tereftalat PET).
4. Proizvodnja vinilhlorida iz etena
1,2-dihloretan je sirovina za proizvodnju vinil-hlorida koji se danas isključivo dobija iz njega. 1,2-dihlor etan može se dobiti adicijom hlora na eten ili oksihlorovanjem etena sa HCl i kiseonikom.
Adicija hlora na eten se odvija u tečnoj fazi pri čemu se nastali dihloretan koristi kao rastvarač. Kao katalizatori se koriste FeCl3, CuCl2 ili SbCl3. Reakcija se izvodi na 40 do 70 ° C pri pritisku od 4 do 5 bara.
![]()
Reakcija se odvija po elektrofilnom jonskom mehanizmu a katalizator izaziva polarizaciju molekula hlora i omogućava elektrofilni napad.
Postupak oksihlorovanja se izvodi u gasnoj fazi. U reakciji etena sa anhidrovanim HCl i vazduhom na 220 do 240 ° C dolazi do prevođenja u dihloretan.
![]()
Kao katalizator se koristi CuCl2 na nosaču. Uloga katalizatora je da
da se ponaša kao hlorujući agens pri čemu se on regeneriše reakcijom sa
HCl i kiseonikom. U ovom postupku ne dolazi do izdvajanja hlora. Modifikacija
ovoga postupka zasniva se na reakciji u vodenom rastvoru CuCl2 zakišeljenom
sa HCl. Prednost ovoga postupka je što se velika količina toplote koja
se oslobađa u ovoj reakciji troši na isparavanje vodene pare. Nedostatak
je problem korozije koji se javlja sa toplim vodenim rastvorom HCl.
2CuCl2 + C2H4 C2H4Cl2 + Cu2Cl2
Cu2Cl2 + HCl + 1/2 O2 2 CuCl2 + H2O
Vinil-hlorid se danas dobija isključivo dehidro-hlorovanjem dihloretana
u gasnoj fazi. Reakcija se izvodi na 500 – 600 ° C pri pritisku od 25
do 35 bara u tubularnim reaktorima. Reakcija se odvija radikalskim mehanizmom.
Ponekad se dodaje mala količina CCl4 kao inicijatora. Oslobođeni HCl u
ovoj reakciji se može koristiti u postupku oksihlorovanja ili se može
koristiti za dobijanje hlora elektrolitički ili oksidacionim postupcima.
![]()
preuzmi
seminarski rad u wordu » » »
