OSTALI SEMINARSKI RADOVI
IZ HEMIJE: |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
MONOHIDROKSILNI ALKOHOLI
Alkoholi su jedinjenja koja sadrže hidroksilnu (-O-H) grupu, vezanu za sp3 (hibridizovan) C-atom alkil ili cikloalkil grupe (-R).Po oksiderivatu etana, CH3CH2OH, koji se trivijalno naziva alkohol,dobila su i sva alifatična i aliciklična oksi-jedinjenja naziv alkoholi.
Dokaz strukture alkohola
1. Dejstvom metalnog natrijuma na alkohole oslobađa se vodonik. Količina
oslobođenog vodonika pokazuje da je reagovao samo jedan vodonikov atom,što
znači da se za jedan H-atom razlikuje od ostalih i da je vezan za kiseonik.
CH3-O-H + Na à CH3-ONa + ½ H2
2. Kada se na alkohole deluje fosfornim halogenidima hidroksilna grupa
se zamenjuje halogenom.
CH3-O-H + PCl5 à CH3-Cl + HCl +POCl3
Klasifikacija alkohola
Prema broju hidroksilnih grupa ,alkoholi su podeljeni na:
1.monohidroksilne (sadrže jednu hidroksilnu grupu)
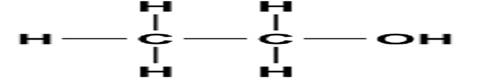
2. polihidroksilne (sadrže dve ili više hidroksilnih
grupa) ,glicerin na slici
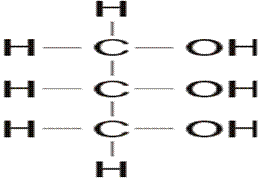
Monohidroksilni alkoholi
Opšta formula monohidroksilnih alkohola je R-O-H (CnH2n+1OH).
Prema vrsti C-atoma za koji je vezana hidroksilna grupa alkoholi su podeljeni na:
1.primarne (1˚)
RCH2OH
2. sekundarne(2˚)
R2CHOH
3.tercijarne (3˚)
R3COH
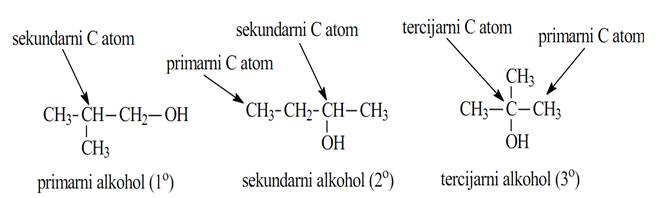
Ove tri vrste alkolola često reaguju različitim brzinama ili mehanizmima ili daju različite reakcione proizvode.
Nomenklatura
Alkoholi se obično nazivaju tako što se ispred reči alkohol stavlja naziv alkil-grupe. Prema IUPAC-sistemu imena alkohola se izvode tako što se na ime odgovarajućeg alkana doda nastavak –ol,a ugljenikov atom za koji je vezana hidroksilna grupa obeležava se brojem.
Alkoholi sa razgranatim nizom posmatraju se kao derivati alkohola sa normalnim, osnovnim, nizom.

Fizičke osobine alkohola
Alkoholi se po svojim fizičkim osobinama znatno razlikuju od ugljovodonika zto sto sadrže polarnu OH grupu. U homologom nizu n-alkohola sa OH grupom na kraju niza,fizičke osobine se pravilno menjaju kao i kod drugih homologih redova.
Ako se uporede tačke ključnja alkohola sa tačkama ključanja ugljovodonika iz kojih su izvedeni, uočljivo je da alkoholi imaju mnogo višu tačku ključanja. Metan, CH4, molekulske mase M=16 ima t.k. 112 K,a metanol, CH3OH, M=32ima t.k. 338 K. Za povećanje molekulske mase od 16 jedinica ne može se očekivati ovoliko povišenje tačke ključanja. Alkoholi u pređenju sa većinom drugih jedinjenja pokazuju izvesne anomalije u pogledu tačke ključanja. Slična anomalija zapaža se i kod vode. Pa je nađeno da prisustvo OH grupe a ne O-atoma,uslovljava visoku tačku ključanja alkohola i vode.
Molekuli alkohola se povezuju vodoničnom vezom, koja ima jačinu od 20 do 40 kJ/mol.
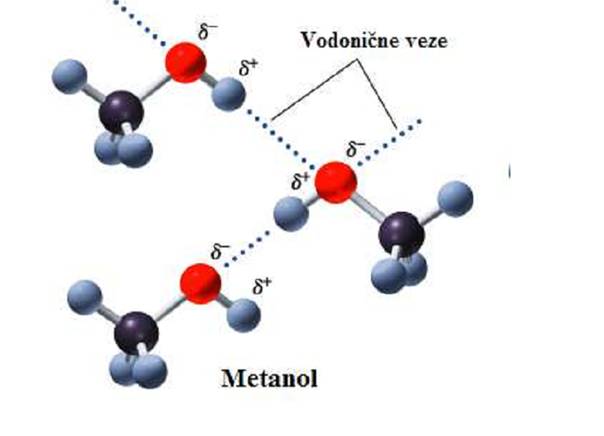
Kod alkohola u tečnom stanju nemamo slobodne molekule, već agregate dva
i više molekula, koji se ponašaju kao posebne čestice, tako da t.k. u
nekoj meri odgovara molekularnoj masi agregata. Povišenje tačke ključanja
prouzrokovano je većom energijom potrebnom za razlaganje vodoničnih veza.
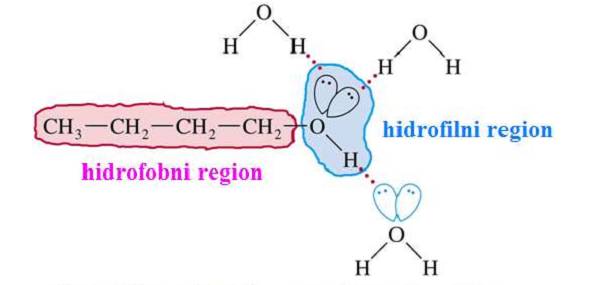
Kod molekula alkohola razlikujemo dva dela,ugljovodonični ostatak koji
je hidrofobni i hidroksilu grupu koja predstavlja hidrofilni deo molekula
i sa vodom gradi vodnočne mostove,što doprinosi njenoj rastvorljivosti
u vodi.
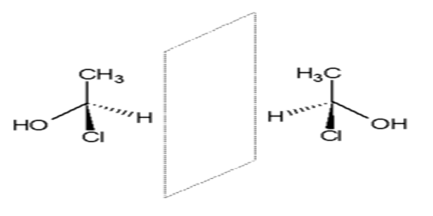
Hiralnost
Ako rastvor organskih supstancija ima osobinu da obrće ravan polarizovane svetlosti za izvestan ugao,bilo u smeru kazaljke na satu (+) ili obrnuto (-),za tu supstanciju kažemo da je optički aktivna. Jedan prost primer optički aktivne supstancije je 2-butanol.Ova dva izomera nazivaju se enantiomeri.
Nalaženje i dobijanje alkohola
Alkoholi su jedinjenja koja su vrlo rasprostranjena u prirodi ili kao slobodni ili u obliku estara. Dobijaju se u laboratoriskim ili industrijskim uslovima na više načina:
- Hidroliza halogenskih derivata
R-X + H-O-H àR-OH + HX
- Hidratacija alkena-sama voda ne reaguje sa alkenima ali u prisustvu sulfatne kiseline dolazi do adicije
R-CH=CH2 + HOH àCH3CH2OH
- Redukcija aldehida i ketona
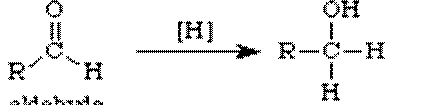
R2-C=O ![]() R2-C-OH
R2-C-OH
- Fermentacija ugljenih hidrata-fermentacijom ili vrenjem šećera pomoću fermenata, enzima, dobijaju se velike količine etanola i drugih alkohola. Kao izvor šečera služi skrob.
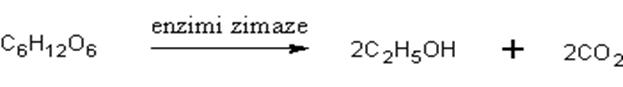
- Hidroliza estara-zagrevanjem estara sa vodom u prisustvu H+ kao katalizatora,estri hidrolizuju u kiselinu i alkohol iz kojih su postali:
CH3COOCH3 + HOH ![]() CH3COOH + CH3OH
CH3COOH + CH3OH
Metil-etanoat metanol
Hemijske osobine alkohola
Alkoholi su reaktivna jedinjenja. Zbog polarnosti –OH grupe vezane za ugljenik, alkoholi mogu da reaguju dvojako:
a) može da dođe do raskidanja-O-H veze, pri čem se izdvaja proton (kiseo karkter alkohola);
b) može da se raskine -C-O veza, pri čemu dolazi do supstitucije ili eliminacije –O-H grupe.
- Reakcija sa metalima. Kada se komadić natrijuma stavi u etanol, dolazi do burne reakcije pri kojoj se natrijum rastvara uz oslobađanje vodonika:
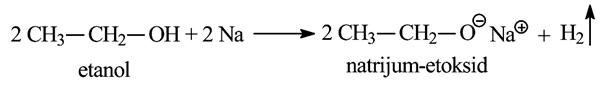
Ova reakcija je analogna reakciji natrijuma sa vodom:
HOH + Na à NaOH + ½ H2
Samo se vrši manje burno (izdvojeni vodonik se ne pali).
U reakciji alkohola sa natrijumom , alkohol se ponaša kao kiselina, a nagrađena so natrijum-alkoholat jeste jaka baza. Dejstvom vode na natrijum-etoksid dobija se etanol i natrijum-hidroksid.
![]()
2. Reakcija sa neorganskim kiselinama i organskim karboksilnim kiselinama. Alkoholi reaguju sa neorganskim kiselinama koje sadrže kiseonik dajući proizvode kod kojih je alkil-grupa vezana preko kiseonika za ostatak kiseline. Ova jedinjena nazivaju se estri:
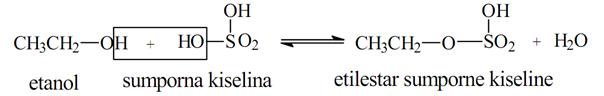
Estri se često nazivaju i kao alkil-soli odgovarajuće kiseline.
Sa karboksilnim kiselinama alkoholi reaguju na isti način dajući estre karboksilnih kiselina:
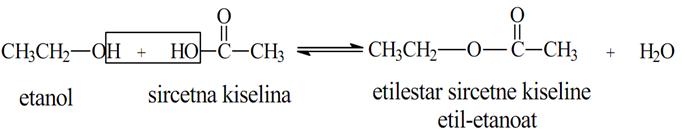
- Reakcija sa halogenovodoničnim kiselinama. Dejstvom HX na alkohole, -OH grupa se zamenjuje halogenom. Reakcija služi za dobijanje haloalkana:
![]()
- Dehidratacija alkohola. Pri zagrevanju u prisustvu mineralnih kiselina alkoholi gube molekul vode i grade alkene. Kao katalizator se obiično upotrebljava sulfatna kiselina i smatra se da intermedijarno postaje estar sulfatne kiseline koji se pri zagrevanju na 344K razlaže:
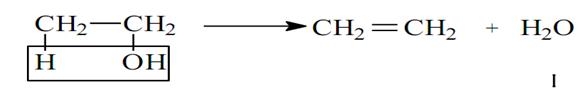
U višku alkohola na 140˚C (413K) postaju etri.
Najlakše gube molekul vode tercijarni,a najteže primarni alkoholi.
![]()
- Dehidrogenovanje akohola. U dodiru sa vrelim metalnim bakrom primarni alkoholi daju aldehide,a sekundarni ketone. Alkohol gubi vodonik iz –OH grupe i još jedan H-atom sa C-atoma za koji je vezana hidroksilna grupa.
R-CH2-OH à H2 + R-CH=O
1˚alkohol aldehid
R2CH-OH à H2 + R2-C=O
2˚alkohol keton
R3-C-OH à NE REAGUJE
3˚alkohol
- Oksidacija alkohola. Oksidaciona sredstva kao što su kalijum-permanganat, kalijum-dihromat itd. Oksiduju alkohole u aldehide i ketone; kojom će se brzonom vršiti oksidacija i koji će se proizvod dobiti zavisi od toga da li se oksiduje primarni,sekundarni ili tercijarni alkohol. Smatra se da se oksidacija vrši tako što intermedijarno postaju estri odgovarajućih neorganskih kiselina,koji se pri zagrevanju razlažu.
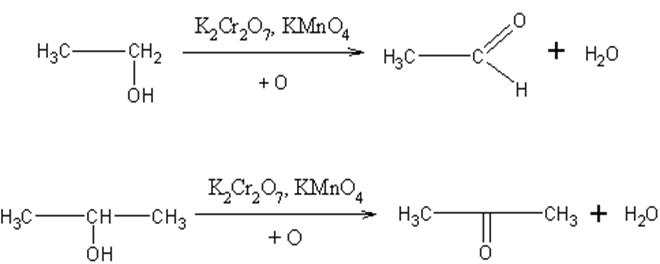
Primarni alkoholi oksidacijom daju aldehide,a sekundarni ketone; tercijarni alkoholi se pod ovim uslovima ne oksiduju. Ali, ako se tretiraju jakim oksidacionim sredstvom na povišenim temperaturama, raskida se C-C veza i dobijaju se oksidacioni proizvodi sa manjim brojem C-atoma.
Najvažniji predstavnici
Metanol (metil-alkohol), CH3OH
Tečnost karakterističnog mirisa koja ključa na 65˚C (338K). Toksičan je,prouzrokuje slepilo, pa čak i smrt.
Upotrebljava se kao odličan rastvarač, kao polazna supstanca za mnoge
organske sinteze, a znatne količine troše se za denaturisanje etanola.
Etanol (etil-alkohol), CH3CH2OH
Etanol koji se dobija destilacijom ,tačka ključanja 78˚C (351K), jeste
95,6% etanol. Apsolutni bezvodni etanol se dobija kuvanjem običnog etanola
sa kalcijum-oksidom,zatim destilacijom i udaljavanjem poslednjih tragova
vode pomoću natrijuma.
Etanol je najviše upotrebljavani rastvarač u organskim laboratorijama.
Koristi se i za proizvodnju alkoholnih pića, u industriji mirisa, u kozmetičkoj
industriji itd.
Veće količine alkohola deluju štetno na jetru i nervni sistem. Da se industrijski
proizvedeni alkohol ne bi upotrebljavao za piće on se denaturiše, tj.
dodaju mu se otrovne supstancije (metanol ili piridin) koji ga čine neupotrebljivim
za piće.
Literatura:
Miroslav V. Piletić i Božidar Lj. Milić, Organska hemija I, Tehnološki fakultet, novi Sad, 1988. godine
Aleksandra Stojiljković, Hemija za III razred gimnazije prirodno-matematičkog smera, Zavod za udžbenike i nastavna sredstva, Beograd, 2002. godine
Reference:
http://en.wikipedia.org/
preuzmi
seminarski rad u wordu » » »
