OSTALI SEMINARSKI RADOVI
IZ HEMIJE: |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
SILICIJUM
Silicijum (Si, latinski - silicium)
je metaloid IVA grupe. Stabilni izotopi silicijuma
su:28Si, 29Si i 30Si.
Najvažnija jedinjenja silicijuma su: oksid silicijuma, koji je glavni sastojak peska i stakla; kiseline silicijuma H2nSimO2m+n, kao i njihove soli, hlorosilikati i alkosilikati.Silicijum se takođe dosta koristi u elektro industriji.Silicijum je drugi element po zastupljenosti(odmah posle kiseonika) na Zemlji.Silicijum slično ugljeniku gradi lance silicijum-silicijum, silicijum-kiseonik-silicijum i silicijum-azot-silicijum. Postoji dosta brojna (oko 300 000) grupa takvih jedinjenja, ipak ima ih dosta manje nego ugljenikovih jedinjenja.Značaj silicijuma za žive organizme ipak nije veliki. Njega neki organizmi koriste za građenje ćelijskog zida, a značajan je kao i sastojak nekoliko enzima. Silicijum je 1822 godine izdvojio Jons Beželius iz SiO2(koji je tada smatran za hemijski element), pretvarajući ga fluorovodoničnom kiselinom (HF) u SiF4 i redukujući ga kalijumom. Rasprostranjenost silicijuma na Zemlji je dosta velika 26,95% i on je drugi element po rasprostranjenosti (odmah posle kiseonika). Kao što ugljenik ima najvažniju ulogu u organskom svetu takvu ulogu silicijum ima u neorganskom, jer SiO2 u raznim oblicima (kvarc, pesak, kristobalit) kao i minerali silikati i alumosilikati čine većinu stena koje grade zemljinu koru.
2. SILICIJUM
 Hipotetična
životna forma bazirana na silikonu Silicijum je jedan od najrasprostranjenijih
elemenata na Zemlji , iako ga nema mnogo u medjuzvezdanom prostoru, pretpostavlja
se da ga cela klasa planeta sličnih Zemlji sadrži u značajnim količinama.
Silicijum je po mnogim hemijskim osobinama sličan ugljeniku - ima sličan
elektronski raspored, gradi relativno jake Si-Si veze. Neki organizmi
na zemlji koriste silicijum u izgradnji svojih egzoskeleta i strukturnih
elemenata. Osim ovih osobina, da bi izgradili sliku eventualnog života
baziranog na silicijumu, neophodno je reći da postoje i osobine ovog atoma
koje značajno ograničavaju njegovu "bioprimenljivost". Silicijum
zbog voluminoznog atoma ne može da gradi dvostruke i trostruke veze, a
silicijumska varijanta prostog ugljenovodoničnog niza (a koji možemo naći
u masti, nafti, ćelijskim membranama i sl.) je izrazito reaktivna sa vodom.
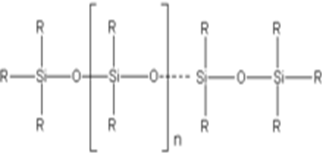
Značajno stabilniji su silikoni - polimeri sastavljeni od nizova naizmeničnih
atoma silicijuma i kiseonika.
Hipotetična
životna forma bazirana na silikonu Silicijum je jedan od najrasprostranjenijih
elemenata na Zemlji , iako ga nema mnogo u medjuzvezdanom prostoru, pretpostavlja
se da ga cela klasa planeta sličnih Zemlji sadrži u značajnim količinama.
Silicijum je po mnogim hemijskim osobinama sličan ugljeniku - ima sličan
elektronski raspored, gradi relativno jake Si-Si veze. Neki organizmi
na zemlji koriste silicijum u izgradnji svojih egzoskeleta i strukturnih
elemenata. Osim ovih osobina, da bi izgradili sliku eventualnog života
baziranog na silicijumu, neophodno je reći da postoje i osobine ovog atoma
koje značajno ograničavaju njegovu "bioprimenljivost". Silicijum
zbog voluminoznog atoma ne može da gradi dvostruke i trostruke veze, a
silicijumska varijanta prostog ugljenovodoničnog niza (a koji možemo naći
u masti, nafti, ćelijskim membranama i sl.) je izrazito reaktivna sa vodom.
Značajno stabilniji su silikoni - polimeri sastavljeni od nizova naizmeničnih
atoma silicijuma i kiseonika.
Još jedna prepreka je činjenica da, dok je ugljen dioksid gas, silicijum
dioksid je čvrsta supstanca, koja je osnovni sastojak peska i stakla
. Ovo postavlja niz problema vezanih za eliminaciju otpadnih produkata
iz organizma, kao i za kruženje raspoložive materije.
Ipak, moguće je pretpostaviti da silikonska jedinjenja mogu biti biološki
korisna u uslovima temperature i pritiska koji se vrlo razlikuju od one
na površini terestrične planete, bilo u kombinaciji sa ugljenikom ili
samostalno, kao osnovni gradivni element života. Sem silicijuma,
u vezi sa ovom tematikom obradjivani su i fosfor, azot, arsen, itd, ali
usled nedostatka prostora i manje-više nepotkrepljenih razmatranja ovi
elementi ovde neće biti obradjivani.
2.1 Silicijum c-Si FN ćelije
Fotonaponske ćelije izrađene od monokristalnog silicijuma imaju tzv. jednoliku strukturu, što znači da se sastoje od istog materijala koji je modifikovan tako da je na jednoj strani ćelije p-sloj, a na drugoj n-sloj Si poluprovodnika. Unutar ćelije, p-n spoj je lociran tako da se maksimum sunčevog zračenja apsorbuje blizu spoja. Površina takvih ćelija zavisi od preseka monokristala od kojeg se proizvode, i iznosi od 5 do 10 cm², debljina im je od 200 do 300 μm. Napon takvih ćelija je od 0,55 do 0,70 V. Teorijska efikasnost im je oko 22 %, dok je stvarna efikasnost oko 15 %. Jedina mana ćelija izrađenih od monokristalnog silicijuma je visoka proizvodna cijena, zbog komplikovanog procesa proizvodnje.
2.2 Silicijum p-Si FN ćelije
Identično c-Si ćelijama, FN ćelije izrađene od polikristalnog silicijuma imaju tzv. jednolika strukturu. Suprotno monokristalnom silicijumu, polikristalni silicijum sačinjen je od više malih kristala, zbog čega dolazi do pojave granica. Granice se suprostavljaju toku elektrona, te ih potiču na rekombinaciju sa šupljinama, što rezultuje smanjenjem izlazne snage takvih ćelija. Postupak dobijanja polikristalne Si FN ćelije identičan je postupku kod c-Si ćelija. Isto tako, presek p-Si FN ćelije identičan je presjeku c-Si ćelije . Jedina razlika je u obliku p-Si ćelija, koje su četvrtaste stoga se mogu bolje složiti u FN module. Proces proizvodnje ćelija od polikristalnog silicijuma je znatno jeftiniji od procesa proizvodnje monokristalnih ćelija, ali p-Si FN ćelije imaju manju efikasnost od c-Si ćelija. Teorijska efikasnost im je oko 18 %, stvarna efikasnost im je između 10 i 13 %.
2.3 Amorfni silicijum a-Si FN ćelije
Atomi unutar amorfnih materijala nisu složeni u neku pravilnu strukturu,
odnosno ne formiraju kristalnu strukturu. Takođe, amorfni materijali sadrže
veliki broj strukturnih defekata te lošu povezanost atoma, što znači da
atomi nemaju susjeda sa kojim bi se mogli povezati. Zbog navedenog razloga
elektroni će se rekombinovati sa šupljinama umesto da formiraju strujni
krug. Budući da defekti limitiraju tok električne struje, ovakve vrste
materijala su inače neprihvatljive u elektronskim uređajima. Defekti se
mogu delimično ukloniti ako se u amorfni silicijum ugradi mala količina
vodonika. Posledica takvog tretiranja amorfnog silicijuma je kombinacija
atoma vodonika sa atomima amorfnog silicijuma koji nemaju suseda (nisu
vezani) tako da elektroni mogu nesmetano putovati kroz materijal
. Amorfni silicijumum upija sunčevo zračenje 40 puta efikasnije u
odnosu na monokristalni silicijum, tako da sloj debljine 1 μm može upiti
oko 90 % energije sunčevog zračenja, naravno kada je obasjan. Upravo to
svojstvo amorfnog silicijuma bi moglo sniziti cenu FN tehnologije.
Ostale prednosti amorfnog silicijuma takođe su ekonomskog karaktera, tako
na primer amorfni silicijum je moguće proizvesti na niskim temperaturama
te može biti položen na jeftine podloge (plastika, staklo, metal i sl.)
što ga čini idealnim za integraciju FN tehnologije kao sastavnog dela
objekata. Najveći nedostatak fotonaponskih ćelija izrađenih od amorfnog
silicijuma je nestabilnost. Zbog delovanja Stabler-Vronskog
efekta izlazna snaga a-Si ćelija se nakon prvog izlaganja sunčevoj svetlosti
smanjuje kroz određeni vremenski period. Delovanje efekta rezultuje gubicima
izlazne snage od 20 % dok se a-Si ćelija nestabilizuje. Treba napomenuti
da a-Si ćelije po podeli spadaju u tzv. tankoslojne materijale. Teorijska
efikasnost a-Si ćelija je oko 11,5 %, stvarna efikasnost je oko 7 % (i
manje).
2.4 Jedinjenja silicijuma sa oksidacionim brojem +4
Ovaj oksidacioni broj silicijum ima u sastavu oksida:silicijum(IV)-oksida (SiO2),kiselina silicijuma i njihovih soli(silikata).Silicijum(IV)-oksid se u prirodi javlja u velikim količinama i to najviše u kristalnom obliku.Osnovne kristalne alotropske modifikacije ovog oksida su: kvarc,tridimit i kristobalit.Ovaj oksid je u manjoj količini u prirodi prisutan i u modifikacijama amorfne strukture- opalu i ahatu.
Njegova najrasprostranjenija kristalna modifikacija je tzv,α-kvarc koji se najčešće naziva samo kvarc.Potpuno čist oblik α-kvarca (bezbojni,providni kristali) se naziva gorski kristal ili biljur.Pored njega postoje i obojeni oblici kristalnog kvarca:ljubičasti-ametist,žut-citrin,mrk-cadjavac itd.U prirodi je najzastupljeniji nečist kvarc u obliku običnog peska koji nastaje raspadanjem alumosilikata u vodi koja sadrži rastvoreni ugljenik(IV)-oksid.Pesak je jedan od najeftinijih i najšire korišćenih gradjevinskih materijala i koristi se kao sirovina za proizvodnju :cementa,stakla,keramike itd.
Osnovna strukturna jedinica ovog oksida su,u različitim modifikacijama različito razmešteni SiO4 tetraedri , u čijem se centru nalaze (sp3) hibridizovani atomi silicijuma koji su jakim kovalentnim vezama povezani sa atomima kiseonika smeštenim na temenima tetraedara.Svaki atom silicijuma je u kristalnoj rešetki ovog oksida smešten izmedju dva atoma kiseonika i formula oksida SiO2 ustvari samo daje odnos brojeva atoma silicijuma i kiseonika.Pojedinačni molekuli ovog sastava zapravo ne postoje.Prava formula ovog oksida je (SiO2)x i u njemu su tetraedri,preko atoma kiseonika,povezani i rasporedjeni različitom gustinom.Najgušći raspored tetraedara i najveću gustinu ima kvarc (ρ=2,655g/cm3) onda tridimit (ρ=2,3g/cm3) pa kristobalit (ρ=2,27g/cm3).
Jake kovalentne veze u ovom oksidu uzrok su što je ovaj oksid teško topljiv
(Tt=17130 C) i tvrd (može da ogrebe staklo).Kristal kvarca poseduje jednu
intresantnu osobinu : pod dejstvom pritiska na mestu nasuprot mesta gde
se vrsi pritisak javlja se naelektrisanje (piezoelektricitet).Hladjednem
rastopljenog silicijum(IV)-oksida on postepeno očvršćava u providnu staklastu
masu koja se naziva kvarcno staklo.Kvarcno staklo se sa porastom temperature
malo širi i zato je pogodno za izradu laboratorijskog posudja (podnosi
nagle promene temperature bez pucanja) a ima i sposobnost da (za razliku
od običnog stakla) propušta ultraljubičaste i infracrvene zrake (primenjuje
se u optičkim instrumentima).Na običnoj temperaturi ovaj oksid je inertan
i reaguje samo sa HF-om dajući silicijum(IV)-fluorid (SiF4) a u višku
heksafluorosilicijumovu kiselinu (H2/SiF6/).Sa bazama ovaj oksid reaguje
sporo i to tek na povišenim temperaturama (topljenjem sa njima).Topljenjem
sa alkalijama ili sa karbonatima alkalnih metala (alkalno topljenje) nastaju
u vodi rastvorne soli –silikati koje imaju izgled sličan staklu i rastvorne
su u vodi i nazivaju se rastvorno staklo.Vodeni rastvori ovih soli se
nazivaju vodeno staklo (koristi se kao lepak za staklo,porcelan,papir,impregnaciju
drveta itd.).Reakcija koja se odigrava izmedju ovog oksida i alkalija
,na povišenoj temperaturi,se uprošćeno prikazuje jednačinom:
SiO2+2NaOH—t→Na2SiO3 +H2O
i njeni produkti ustvari predstavljaju smešu različitih silikata.Dodatkom
kiseline u vodeno staklo nastaju ,u vodi malo rastvorne ,kiseline silicijuma
odnosno (u zavisnosti od koncentracije rastvora njihovi koloidni rastvori-soli
ili koloidni talozi-geli ) čiji je sastav različit i zavisi od količina
uzetih reaktanata.Sušenjem i žarenjem gela (koloidnog taloga) ovih kiselina
dobija se supstanca ogromne specifične površine (do 400 m2 na 1 gram)
silikagel koja je efikasno sredstvo za prečišćavanje.
Duze udisanje sitnih cestica (2-10 hiljaditih delova milimetra). prasine
koja sadrzi SiO2 dovodi do pojave bolesti koja se zove silikoza .Ona se
sastoji u akumuliranju čestica ovog oksida u plućima zbog čega ona postaju
tvrda i neelastična.Spoljne manifestacije su kašalj i disanje praćeno
zviždanjem.
Reakcija ovog oksida sa bazom ustvari pokazuje da je on po svojim kiselo-baznim reakcijama kiseli oksid i anhidrid kiselina silicijuma koje su product različitog stepena njegove hidratacije.Sastav ovih kiselina se može prikazati sledećim opštim formulama:
Opšta formula kiselina Vrednost koeficijenata Formula kiseline Naziv kiseline
silicijuma
n=1 H2SO3 metasilicijumova
SiO2.nH2O n=2 H4SiO4 ortosilicijumova
n=1 H2Si2O5 dimetasilicijumova
mSiO2.nH2O m=2
n=3 H6Si2O7 diortosilicijumova
m=2
Kiseline sa jednim atomom silicijuma u svom molekulu nazivaju se silicijumove a one sa više atoma su polisilicijumove kiseline.U strukturi polisilicijumovih kiselina atomi silicijuma povezani preko kiseonika (kiseonični mostovi) .Sve kiseline silicijuma su slabe,nepostojane i malo rastvorne u vodi sa kojom daju ne molekulsko–dispersne (prave ) već koloidne rastvore i nisu izolovane u čistom obliku One su zapravo izvedene iz njihovih soli (silikata) koji su u ogromnoj količini prisutne u litosferi.Smatra se da su tzv prosti silikati nastali potpunom ili delimičnom zamenom atoma vodonika iz ovih kiselina atomima metala.Primer prostog silikata je
mineral kaolinit koji je aluminijumova (aluminijum katjon Al3+ ) so polisilicijumove
kiseline ( u kojoj su koeficijenti m=2 i n=5).Prosti silikati su nerastvorni
u vodi a dobro rastvorni u vodi su samo prosti silikati alkalnih metala
i amonijuma.
U prirodi su znatno rasprostranjeniji tzv.složeni silikati koji predstavljaju
soli kiselina silicijuma u kojima su atomi silicijuma zamenjeni (ili delimčno
zamenjenji dajuci anjone različitih naelektrisanja) atomima aluminijuma
tzv.alumosilikati.Znatno su manje rasprostranjeni u litosferi silikati
u kojima je zamena atoma silicijuma atomima aluminijuma izvršena delimicno.
Osnovna strukturna jedinica svih silikata je SiO44- jon koji je tetraedarskog
oblika u čijem se centru nalazi atom silicijuma .Ovaj jon ima snažnu tendenciju
da se medjusobno povezuje dajući pri tome prstenove,lance,trake,slojeve
odnosno silikate koji se medju sobom razlikuju po svojim kristalnim rešetkama
i fizičko-hemijskim karakteristikama..Za sve njih je karakteristicno da
su zbog velikih jačina kovalentnih veza izmedju atoma silicijuma i kiseonika
na običnoj temperaturi hemijski inertni i nerastvorni u vodi.
Struktura silikata se detaljnije proučava u okviru predmeta mineralogija
i petrografija .
2.5 KVARC
Kvarc (SiO2) je mineral koji spada u silikate. Pre svega potrebno je naglasiti da su minerali prirodni spojevi nastali prirodnim (geološkim) procesima koji su karakterističnog hemijskog sastava, imaju strogo uređenu atomsku strukturu i različite fizičke karakteristike. Termin "mineral" obuhvaća ne samo hemijski sastav materijala, već i strukturu minerala (kristalna rešetka). Minerali se po sastavu kreću od čistih elemenata (poput samorodnog zlata, samorodnog srebra ...) i jednostavnih soli do veoma složenih silikata s tisućama poznatih oblika.Trenutni broj poznatih minerala u prirodi je preko 4.000. Od njih preko 120 su česti u prirodi. Minerali se nalaze u stijenama u prirodi i izučavanje minerala je bitno za izučavanje stena jer se na osnovu njihovih karakteristika može zaključiti kakva je bila geneza stijena, dakle, u kojim uslovima su nastale.
S obzirom na veliki broj minerala oni su podjeljeni u trinaest mineralnih razreda. Jedan od tih razreda su silikati, koji su bitni jer u njih spada kvarc tema seminarskog rada. Silikati su najveći razred minerala (većina stijena na Zemlji građena je od čak 95% silikata), koji čine većinom silicijum i kiseonik, s dodacima io na poput aluminijuma, magnezijuma,gvožđa i kalcijuma. Neki važni minerali iz ove grupe, a koji čine stene jesu feldspati, kvarc, olivin, piroksin, amfiboli, granati i tinjaci.
Kvarc je drugi po redu (po učestalosti) mineral koji se pojavljuje u prirodi i sam čini 12% Zemljine kore. Pojavljuje se u čistom obliku ili zajedno s drugim elementima kao silikat. Kvarc može biti: beli (mliječni), bezbojni (kameni kristal), ljubičasti (Ametist), ružičasti, sivi (dimni), smeđi (kaingorn), crni (morion), žuti (citrin) i zeleni (prejz). Kvarc ima trvdoću 7 na Mosovoj skali . Ima beli ogreb i staklast sjaj. Ima vrlo široku primenu i nezamjenjiv je u mnogim sferama ljudskog života. Za kvarc se kaže da je on izvorna priroda koja neposredno pomaže savremenoj tehnici.
2.5.1 Naziv, formula, klasifikacija
Reč "kvarc" je izvedena iz nemačke reči " quarz",
koja je vezana sa reci "twarc" iz srednjovekovnog nemačkog jezika.
Ova reč vodi poreklo iz slavenskih jezika (Češki tvrdy, Poljski twardy).
Hemiska formula kvarca se sastoji od okvira silicijuma i kiseonika tetraedara
SiO4, sa svakim silicijumom deli dva kiseonika pa daje ukupnu formulu
SiO2. Kvarc pripada romboedarskom kristalnom sistemu. U prirodi kvarcni
kristali su često dvostruki, iskrivljeni, i tako srasli sa susednim kristalima
kvarca ili drugih minerala.
Mikroskopske strukture kristala: α-kvarc kristalizira u trigonalnom kristalnom
sistemu β-kvarc pripada heksagonalnom sistemu.
3. FIZIČKE OSOBINE SILICIJUMA
Silicijum postoji u dva oblika koji nisu različite alotropske modifikacije:u obliku mrkog praha i u obliku tamno sivih ,neprozirnih i veoma tvrdih ,sjajnih,igličastih kristala.Međutim kristalna struktura oba oblika silicijuma je identična i jednaka kristalnoj strukturi dijamanta.Otuda sijicijum ima visoku temperaturu topljenja i ključanja (1420 i 3250 0 C) koje su posledica postojanja jakih kovalentnih veza u njihovoj atomskoj kristalnoj rešetki .Ovi oblici se među sobom razlikuju samo po veličini čestica i razvijenosti površine njihovih čestica:čestice su sitnije i površina je razvijenija kod praškastog nego kod kristalnog oblika silicijuma.
4. HEMIJSKE OSOBINE SILICIJUMA
Elektronska konfiguracija atoma silicijuma je:
Si 1s2 2s22p6 3s23p2 pokazuje da on ima četiri valentna elektrona usled čega gradi jedinjenja u kojima ima oksidacioni broj izmedju –4 I +4 (minimalni i maksimalni ostvaruje rasparivanjem elektronskog para iz s orbitale).Vrednosti potencijala jonizacije ( I-IV su 8,15;16,3;33,5 i 45,1 eV) i koeficijenta elektronegativnosti (1,8) su takve da atom ovog elemenata ne gubi niti prima elektrone već gradi jedinjenja sa kovalentnim vezama.Na običnoj temperaturi je ,zbog jakih kovalentnih veza medju atomima ,nereaktivan.Na povišenoj temperaturi, zbog raskidanja veza među atomima, njegova reaktivnost raste.Kristalni oblik silicijuma je manje reaktivan od silicijuma u obliku praha.Na sobnoj temperaturi reaguje samo sa fluorom dajuči silicijum(IV)-fluorid SiF4 , na povišenoj sa kiseonikom dajuci silicijum(IV)-oksid SiO2 i sa mnogim metalima i nemetalima dajući silicide.Silicidi su redje jonskog (sa
metalima najmanje elektronegativnosti),češće kovalentnog a najčešće metalnog karaktera.Najpoznatiji su silicidi kalcijuma čiji sastav zavisi od načina njihovog pripremanja,odnosno količina uzetih reaktanata (Ca2Si2,CaSi2 i Ca2Si).Ne reaguje sa kiselinama na sobnoj temperaturi (izuzetak smeša HF i HNO3).Na povišenoj temperaturi reaguje sa jakim bazama dajući soli-silikate. Jedinjenja silicijuma sa vodonikom se nazivaju silikovodonici i njihova opšta formula je analogna opštoj formuli zasićenih ugljovodonika-alkana (SinH2n+2) .U njima silicijum,kao pozitivniji elemenat od vodonika , nema negativan oksidacioni broj za razliku od atoma C u ugljovodonicima .Ova jedinjena su nestabilna.Najznačajnija su jedinjenja silicijuma sa oksidacionim brojem +4.
5. SILICIJUM DIOKSID
Silicijum dioksid (SiO2) se javlja u tri alotropske modifikacije: kvarc, tridimit i kristobalit. Svaki od ova tri oblika postoji još u dvije modifikacije (α i β)
5.1 HEMIJSKE OSOBINE SILICIJUM DIOKSIDA
Silicijum dioksid je prilično inertan. Ne reaguje sa kiselinama,
osim sa fluorovodoničnom kiselinom (HF). Taljenjem sa alkalnim hidroksidima prelazi
u rastvorljive silikate:
SiO2 + 2 NaOH → Na2SiO3 + H2O
Kiselina koja odgovara silicijum dioksidu naziva se ortosilikatna
kiselina, ali se ne može dobiti kao kod oksida nemetala rastvaranjem
u vodi, jer je silicijum oksid netopiv. Najlakši način je hidroliza silicijum
tetrahlorida:
SiCl4 + 4 H2O → H2SiO4 + 4 H+ + 4 Cl-
Ova kiselina u monomolekularnom obliku postoji pri pH oko 3,2.
Pri nižim ili višim vrijednostima počinje polimerizirati.Soli silikatnih
kiselina se nazivaju silikati. Samo alkalni silikati se
rastvaraju u vodi. Polimerizirana silikatna kiselina prelazi u gel,
čijim sušenjem nastaje silikagel.
5.2 UPOTREBA SILICIJUM DIOKSIDA
Silicijum dioksid je jedna od osnovnih komponenata u proizvodnji stakla. Važnu grupu minerala čine silikatni minerali. Zamjenom OH-grupa u silikatnoj kiselini organskim radikalima, moguće je kontrolisati reakciju kondenzacije, pri čemu nastaju polimerni spojevi strukture slične ketonima R2C=O, pa se nazivaju silikoketoni ili silikoni.
6. ILICIJUM I INTELEGENCIJA
Posmatrano iz naše ograničene perspektive, izgleda da je ugljenik jedini
element koji je u stanju da oblikuje život. Sve što znamo ili smo u stanju
da zamislimo, rezultat je beskonačne sposobnosti ugljenika da se jedini
sam sa sobom i sa drugim elementima, izgrađujući tako dugačke lance. Oblici
života zahtevaju kako složene strukture, tako i manje molekule; izgleda
da samo ugljenik daje i jedno i drugo. U svojoj klici 'Kosmos' Karl Sagan
razmišlja i o postojanju vanzemaljskih civilizacija, pri čemu u svim alternativnim
biologijama uvek polazi od ugljenika.
Silicijum je najbliži hemijski srodnik ugljenika. Organska
hemija silicijuma, međutim, krajnje je siromašna u poređenju sa hemijom
ugljenika. Ono što je interesantno, jeste elementarni silicijum. On je
tako interesantan da baca u zasenak čitavu zgradu životnih oblika, koja
počiva na ugljeniku.
Veliki problem u zasnivanju živih sistema, jeste očuvanje
strukture, granica i poruka nasuprot opšte tendencije stvari da se mešaju.
Problem je kako stvari održati odvojenima. Genetski kod životnih oblika
zasnovanih na ugljeniku, efikasan je metod sprečavanja povratka na prebiotsku
supu iz koje su ti oblici nastali
. U tehnologiji integrisanih kola, međutim, dominantni ugljenični
oblik života (naš sopstveni) našao je daleko jednostavniji metod da se
informacioni kanali očuvajunetaknutim.
Provodljivost silicijuma može se menjati njegovim 'dopingovanjem' elementima,
kao što su fosfor ili bor, i u kristalu se mogu stvarati prolazi za električnu
struju. Ako se tome doda činjenica da silicijum dioksid, koji se u obliku
površinske prevlake lako stvara zagrevanjem u kiseoniku, predstavlja odličan
izolator, eto načina da se stvore nebrojeni električni prolazi, što veoma
podseća na veze između ćelija mozga, ali bez glomaznog aparata koji podržava
život. Ne izgleda verovatno da je fina striktura mozga
iole složenija od logičkih elemenata ugrađenih u silicijumski čip. Sposobnost
mozga potiče od ogromnog broja veza koje su moguće između njegovih ćelija,
ne od složenosti pojedinačnih ćelija. Kada se vodovi integrisanih kola
budu približili molekulskim dimenzijama (ako već nisu u tajnim i vojnim
laboratorijama), mogući broj veza moći će sasvim da konkuriše broju veza
kod čovekovog mozga. Tada ćemo otkriti da li je spospobnost da se mnogo
miliona puta u sekundi razazna nula od jedinice dovoljan uslov za inteligenciju.
U slučaju potvrdnog odgovora, to će izazvati sledeće pitanje: čemu sva
ta strka oko ugljenika, kada silicijum može da služi mnogo bolje? Ili,
da li smo zaista bili potrebni mi da bi se otkrio silicijumski čip?
Osnovni cilj ovog diplomskog (maturskog) rada je da pojasni i definiše
silicijum. Takođe, pokušala sam da prikažem osnovne osobine silicijuma
i njihovu podele.
Cilj mi je bio i da prikažem osnovne prednosti i nedostatke silicijuma.
Međutim, najvažniji i praktični deo rada odnosi se na opšti pojam
silicijuma njegove fizičke i hemijske osobine kao i silicijum dioksid.
Koristeći dva izvora informacija ( knjige i internet ) o silicijumu a
takođe i mojim interesovanjem i željom da što dublje predstavim ovaj hemijski
element, mislim da sam doprinela kvalitetu diplomskog ( maturskog ) rada.
1. Stojiljković Aleksansdra: Hemija, ZUNS, Beograd, 2003.
2. Horvat Rozalija: Neorganska hemija, ZUNS, Beograd, 2002.
3. Arsenijević Stanimirt.: Neorganska hemija, Beograd,1999.
4. Biščević Smail.: Neorganska hemija,Sarajevo, 2005.
5. Grupa autora: Metalurgija
6. Grupa autora: Analitička hemija
7. Grupa autora: Hemijski praktikum za neorgansku hemiju
8. www.agencijalibro.com
preuzmi
seminarski rad u wordu » » »