OSTALI SEMINARSKI RADOVI
IZ BIOLOGIJE : |
|||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||
EPIGENETIKA
 Za
razliku od genomike, koja se temelji na proučavanju građe – anatomije
gena, epigenetika se temelji na izučavanju nasljednih varijacija u aktivnosti
gena, dakle njihovoj fiziologiji. Osnovni epigenetički procesi, regulatori
aktivnosti gena su metilacija molekula DNK
i posttranslacijske modifikacije histona. Ova dva procesa međusobno se
nadopunjuju pri čemu stvaraju epigenetičku mrežu događaja koja u završnici
reguliše aktivnost pojedinih gena. Uspostavljanje određenog tipa epigenetičke
mreže zavisi o anatomiji gena i njegovog promotora kao i stalnom međudjelovanju
egzogenih i endogenih faktora koji dovode do stvaranja karakterističnog
epigenetičkog obilježja. Sve se više uviđa važnost reverzibilnosti formiranje
i uklanjanja epigenetičkih molekularnih obilježja u svim, a naročito u
zloćudnim bolestima. Istraživanja u području epigenomike, primjene novih,
epigenomskih pristupa u liječenju, a posebno u području razvoja “pametnih”,
epigenetičkih lijekova, u uzlaznoj su putanji koja još uvijek nije dostigla
svoj zenit.
Za
razliku od genomike, koja se temelji na proučavanju građe – anatomije
gena, epigenetika se temelji na izučavanju nasljednih varijacija u aktivnosti
gena, dakle njihovoj fiziologiji. Osnovni epigenetički procesi, regulatori
aktivnosti gena su metilacija molekula DNK
i posttranslacijske modifikacije histona. Ova dva procesa međusobno se
nadopunjuju pri čemu stvaraju epigenetičku mrežu događaja koja u završnici
reguliše aktivnost pojedinih gena. Uspostavljanje određenog tipa epigenetičke
mreže zavisi o anatomiji gena i njegovog promotora kao i stalnom međudjelovanju
egzogenih i endogenih faktora koji dovode do stvaranja karakterističnog
epigenetičkog obilježja. Sve se više uviđa važnost reverzibilnosti formiranje
i uklanjanja epigenetičkih molekularnih obilježja u svim, a naročito u
zloćudnim bolestima. Istraživanja u području epigenomike, primjene novih,
epigenomskih pristupa u liječenju, a posebno u području razvoja “pametnih”,
epigenetičkih lijekova, u uzlaznoj su putanji koja još uvijek nije dostigla
svoj zenit.
Još je donedavno većina nas bila uvjerena da sklonost nastanku bolesti zavisi isključivo o nasljednim informacijama pohranjenim u molekulu DNK. Shodno tome, puno je učinjeno kako bi se uspostavile funkcionalne veze između promjena u strukturi molekula DNK (npr. mutacije, spajanje gena koje za posljedicu ima nastanak kimeričnog proteina, amplifikacije gena koje dovode do promijenjene aktivnosti gena) i nastanka određenih bolesti . Ovaj je pristup ponudio odgovore na veliki broj pitanja koja su, u završnici, dovela do otkrića gena koji, ako su mutirani, dovode do nastanka bolesti kao što je to, na primjer, slučaj s cističnom fibrozom. Ali uprkos očiglednom napretku još uvijek nepostoje odgovori na dodatna, još uvijek neodgovorena pitanja. Je li isključivo raspored baza (GATC) u molekulu DNK stvarni ključ koji će, s vremenom, otvoriti sve brave? Svakodnevne dileme nakon završenog projekta Genom čovjeka možda je najbolje opisao Manel Esteller, direktor Laboratorija za epigenetiku raka pri Nacionalnom institutu za rak, Španija, koji je rekao: “Vrijeme je da posložimo ovaj veliki telefonski imenik i napravimo nekoliko telefonskih poziva kako bismo bili sigurni da su imena i adrese vezani uz ispravne brojeve.“ Na temelju ove izjave postaje vrlo jasno da naučnu radoznalost i višeslojevito znanje treba preusmjeri u neka nova područja biologije.
Tek se nedavno postalo svjesno važnosti epigenomskih struktura u razvoju
i pojavi bolesti . Sama riječ znači “izvan konvencionalne genetike”, a
njezin tvorac je razvojni biolog Conrad Waddington. Rođen u Eveshamu,
Engleska, 1905., Waddington je već 1947. pokrenuo osnivanje Odjela za
genetiku u Institutu Edinburgh. Za samo deset godina genetička istraživanja
u ovom Institutu postala su prepoznatljiva po vrhunskom kvalitetu , a
sam Odjel bio je više nego uspješan i postao je jedan od najvećih odjela
genetike u svijetu. Tokom tih godina, Waddington je planirao stvaranje
laboratorija za epigenetiku. U svojoj je namjeri uspio tek 1965., kada
je i službeno osnovana Grupa za epigenetička istraživanja, s Waddingotonom
kao počasnim direktorom na čelu. Nažalost, razvoj ove grupe nije se odvijao
u skladu s njegovom vizijom koja je primarno bila usmjerena u područje
embriologije. Naime, materijalna je podrška bila preusmjerena u ona područja
nauke u kojima su se otkrića temeljila na hibridizacijskim tehnikama vezanim
uz molekule DNK i RNK, koje se u to vrijeme u embriologiji nisu koristile.
Waddington je, za razliku od mnogih embriologa svog vremena, u to vrijeme
bio ne samo cijenjen embriolog, nego i jedna od rijetkih osoba koja je
bila svjesna značaja genetike u razvoju, ili, još preciznije, značaja
aktivnosti materijala jezgra (gena) za događanja u citoplazmi. Waddington
je postavio hipotezu o mogućoj nadopunjivosti epigeneze (stari naziv za
embriološki rast i diferencijaciju) i preformacije, tvrdeći da “...su
sve karakteristike odraslog organizma prisutne u oplođenoj jajnoj ćeliji,
ali se trebaju “odmotati ” i razviti ...”. Na temelju toga je razvoj smatrao
epigenetičkim događajem: “…moglo bi se reći da epigenetsku građu ili epigenotip
čini niz događaja kroz koje određeno tkivo prolazi tokom razvoja; znači
– određeni organ nastaje zbog ličnih međudjelovanja genotipa, epigenotipa
i spoljašnjih faktora”. Waddington je preminuo 19753. Njegove su ideje,
ponekad nepotpuno razrađene, ostale “uskladištene” tokom velikog broja
godina, neprepoznate kao skriveno blago koje ponovo otkrivamo u epigenomici
novog doba. Njegov je način razmišljanja bio nevjerojatan u svojoj otvorenosti
prema nepoznatom. Njegove su hipoteze nastajale u vrijeme kada ih tehnički
nije mogao potvrditi bez antitijela, bez rekombinantne tehnologije DNK,
bez ikakvih saznanja o tome kako su geni građeni i na koji bi način njihova
akti vnost uopšte mogla biti regulisana. Utoliko više njegovo vizionarsko
prepoznavanje “nečega” što je tada nazvao “epigenetika” zaslužuje najdublje
poštovanje. Danas epigenetiku definišemo kao “nasljednu i reverzibilnu
promjenu funkcije gena”, nazavisno o slijedu baza u molekulu DNK. Za razliku
od epigenomike, koja proučava globalnu sliku epi-događaja u određenom
genomu, epigenetika ima sužen fokus i proučava specifične epi-promjene
vezane uz tačno određene gene. Svjesni smo nasljeđivanja epigenetičkih
oznaka na nivou ćelije i na nivou organizma. Postali smo svjesni važnosti
ovih oznaka u razvoju, u diferencijaciji ćelije i u zaštiti od ugradnje
genoma virusa. Ove su oznake , regulatori aktivnosti gena, kritične u
obilježavanju molekularnih signala koji nastaju zbog djelovanja egzogenih
ili endogenih faktora. Pojednostavljeno, oznaka od gena “zahtjeva” da
svoju aktivnost prilagodi novonastalom stanju. U fiziološkim uslovima ćelija
mora modelirati svoj epigenom trenutno, ponekad u sekundi. To joj omogućuje
prilagodođavanje na signale zbog kojih neki geni trebaju biti umireni,
a drugi postaknuti . Ovo se događa kroz ciljano uklanjanje ili dodavanje
oznaka metilacije na molekulu DNK, odnosno mijenjanjem strukture oktamera
histona. Ova su dva događaja baza epigenomskog odgovora. Suprotno tome,
nemogućnost modeliranja ovih dvaju molekularnih događaja dovodi do nastanka
bolesti . Prvi materijal koji je ukazao na važnost epigenomskih promjena
u nastanku raka štampan je
1983. godine, ali tada važnost tog otkrića nije bila prepoznata.
NAJVAŽNIJI EPIGENETSKI MEHANIZMI
Najvažniji epigenetski mehanizmi su metilacija molekula DNK, uspostavljanje kovalentnih, posttranslacijskih promjena histona (metilacija, acetilacija, fosforilacija, sumoilacija) i umirivanje gena zavisno o malim molekulama RNK. Ova tri najvažnija epigenetska mehanizma usko su povezana u uspostavljanju lične (epigenomske) mreže signala unutar koje se međusobno nadopunjuju i upravljaju važnim procesima u ćeliji. Vrlo su važni i u odgovoru ćelije na djelovanje mutagena (u ovom kontekstu “epimutagena”) iz okoline.
METILACIJA MOLEKULA DNK I TRANSKRIPCIJA GENA
 Približno
56% gena čovjeka u području promotora posjeduje područja bogata citozinima
i guaninma. Ova područja zauzimaju tačno određena mjesta u genomu i pritom
čine njegovih 1 – 2%. Nazivaju se “ostrvca CpG” koji su definisani kao
područja duža od 500 parova baza koja posjeduju više od 55% nukleotida
s bazama G + C. Ova su područja uglavnom nemetilisana u normalnoj zdravoj
ćeliji. Izuzetke čine promotori upisanih gena , područja hromosoma X –
vezano uz njegovu nasumičnu inaktivaciju i područja transpozona. U funkcionalnom
se smislu metilacija molekula DNK, kao izuzetno važan biološki fenomen,
proučava primarno na nivou transkripcije gena pri čemu se najpojednostavljeniji
scenarij može odvijati na dva nivoa: metilisani promotor – gen je umiren,
nemetilisani promotor – gen je aktivan. Vrlo osjetljiv i precizan proces
tokom kojeg citozin postaje metilisan predstavlja osnovni mehanizam normalnog
razvoja u svih vrsta, a pritom i dodatno pojašnjava “vremensku i tkivno
specifičnu ekspresiju”. Jednostavno; svi posjedujemo 46 hromosoma koji
na sebi imaju sve naše gene, ali nisu svi naši geni stalno aktivni u svim
tkivima. Metilacija molekula DNK u biohemijskom smislu predstavlja kovalentno
vezanje metilne grupe na 5. atom ugljenika, u ostrvcu CpG.
Približno
56% gena čovjeka u području promotora posjeduje područja bogata citozinima
i guaninma. Ova područja zauzimaju tačno određena mjesta u genomu i pritom
čine njegovih 1 – 2%. Nazivaju se “ostrvca CpG” koji su definisani kao
područja duža od 500 parova baza koja posjeduju više od 55% nukleotida
s bazama G + C. Ova su područja uglavnom nemetilisana u normalnoj zdravoj
ćeliji. Izuzetke čine promotori upisanih gena , područja hromosoma X –
vezano uz njegovu nasumičnu inaktivaciju i područja transpozona. U funkcionalnom
se smislu metilacija molekula DNK, kao izuzetno važan biološki fenomen,
proučava primarno na nivou transkripcije gena pri čemu se najpojednostavljeniji
scenarij može odvijati na dva nivoa: metilisani promotor – gen je umiren,
nemetilisani promotor – gen je aktivan. Vrlo osjetljiv i precizan proces
tokom kojeg citozin postaje metilisan predstavlja osnovni mehanizam normalnog
razvoja u svih vrsta, a pritom i dodatno pojašnjava “vremensku i tkivno
specifičnu ekspresiju”. Jednostavno; svi posjedujemo 46 hromosoma koji
na sebi imaju sve naše gene, ali nisu svi naši geni stalno aktivni u svim
tkivima. Metilacija molekula DNK u biohemijskom smislu predstavlja kovalentno
vezanje metilne grupe na 5. atom ugljenika, u ostrvcu CpG.
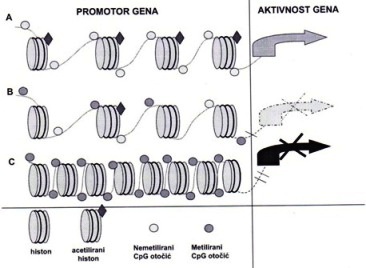
1. Shematski prikaz epigenetičkih promjena u genu čiji
je promotor bogatom CpG ostrvcima.A. Histoni su acetilirani, CpG ostrvca
su nemetilisani, gen je aktivan. B. Dio histona je izgubio acetilne grupe,
dioCpG ostrvaca je metilisan, gen nije aktivan, ali je promjena reverzibilna.
C. Histoni su hipoacetilirani, a CpG ostrvca metilirani. Gen je u miren,
promjena je ireverzibilna.
Ovaj biološki proces nije posebno važan samo u razvojnoj biologiji. Važan je i za patofiziologiju bolesti, s posebnim naglaskom na zloćudnu bolest. Značaj ovog procesa je pokazan u experimentnim modelima u kojima različito aktivni transgeni (aktivni ili umireni, zavisno o stepenu metilacije) zadržavaju obrazac aktivnosti tokom stotinjak dioba. Umreženi signali koji su odgovorni za tačno kopiranje obrasca metilacije iz generacie u generaciju zavise o dva pa DNK meti ltransferaza (DNMT): DNMT3A i DNMT3B. Ova dva enzima posjeduju metilacijsku aktivnost ”de novo”, što znači da su neophodni za uspostavljanje obrasca metilacije tokom ranog razvoja jedinke.Nakon njegove uspostave aktivira se DNK metiltransferaza DNMT1 koja je odgovorna za tačno kopiranje uspostavljenog obrasca u sljedeću generaciju ćelija. Bez ovih bi enzima život bio nemoguć, što je i pokazano na primjeru miševa. Životinje kod kojih su ovi enzimi bili umireni uginule su tokom ili nakon završenog embrionalnog razvitka, a u cjelokupnoj je “slici” prevladavala globalna hipometilacija molekule DNK. Tokom zloćudnog preobražaja ostrvaca CpG koji se nalaze u područjima promotora gena koji su neophodni za njezin nastanak postaju hipermetilirani. Posljedica ovog događaja je umirivanje tumorsupresorskih i drugih gena koji su odgovorni za nastanak raka. Dva modela objašnjavaju pretjeranu metilaciju promotora i umirivanje gena. Prvi se temelji na činjenici da se metlirani citozin “istegne” u veliki zavoj molekule DNK i pritom izazove promjenu konformacije. To za posljedicu ima nemogućnost vezanja faktora transkripcje na ciljno CpG - vezno mjesto. Drugi nas model ponovo približava Waddingtonovoj “mreži” i temelji se na funkciji proteina MeCP2 (engl. methylcytosine binding proteins). Kao što i samo ime govori, ovi se proteini vežu za metlirana ostrvca CpG i pritom stvaraju prepreku zbog koje se faktori transkripcije ne mogu vezati. Ova je objašnjenja lako razumjeti, no u stvarnosti je ovaj proces vrlo složen i zavisi o puno molekula.
MODIFIKACIJE HISTONA
Deacetilaze histona su proteini – enzimi, uključeni u proces uklanjanja
acetilne grupe iz repa histona. Ovaj je događaj ključan u umirivanju gena.
U “pojednostavljenom” biološkom scenariju, deacetilacija histona za posljedicu
ima “zgušnjavanje” kompleksa DNK-histon (slika 1C). Ova promjena konformacije
također stvara fizičku prepreku zbog koje se faktori transkripcije ne mogu
vezati za ciljno mjesto na promotoru gena koji se zbog toga umiri. No,
“pravi” scenarij koji se odvija na nivou epigenomske komunikacije puno
je složeniji: deacetlacija histona je praćena aktvacijom DNK-metilaza
koje dovode do lokalne hipermetilacije molekule DNK, u području promotora.
Sve je veći broj podataka koji upućuju na vrlo živahnu molekularnu epigenetičku
komunikaciju koja posreduje “izmjeni informacija” na nivou “acetilacija
histona” – “metilacija DNK”. Ovo se dešava u strogo određenoj kaskadi
događaja. Vrlo često se osjećamo nemoćnima u razumijevanju ovih zakonitosti
jer nismo u mogućnosti razaznati razliku između uzroka i posljedice. Konkretno,
koji bi epigenetički proces ili koja bi molekula trebala biti “napadnuta”
kao primarna epigenomska meta u liječenju raka? Ako ciljamo u određenu
molekulu pa onda, posljedično, utječemo na signalne puteve za koje trenutno
ne znamo da su uključeni u “komunikacijsku mrežu”, koliku štetu ćemo izazvati
? Da li bi se pristup trebao razlikovati od osobe do osobe, od tkiva do
tkiva? Odgovore na ova pitanja još nemamo, a potraga za njima čini ovaj
tip istraživanja veoma zahtjevnim i zanimljivim.
Ono što sigurno znamo temelji se na nekoliko vanrednih istraživanja od
kojih ćemo spomenuti samo jedno, prvo kojim je pokazano da acetilacija
histona sprječava metilaciju molekule DNK i to tako da: a) “spriječi”
pristup DNK-metilazama, a u isto vrijeme b) pozitivno djeluje na vezanje
faktora transkripcije, prvenstveno zahvaljujući prekomjernoj acetilaciji
histona H3 i H4. Znači, na nivoui “globalnog”, acetilacija histona ima
suprotni učinak u odnosu na metilaciju molekule DNK i dobro korelira s
globalnom transkripcijskom aktvnošću. Prema tome, primjena inhibitora
deacetilaza histona (HDAC; engl. histone deacetylase) podržavaće acetilaciju
histona i, posljedično,uticati na stepen metilacije promotora gena. Ovo
je kristalno jasno pokazano u modelu karcinoma prostate čovjeka, na 131
uzorku tkiva tumora i 65 uzoraka dobroćudnog, ali hipertrofičnog tkiva
prostate. U experimentima je praćeno ponašanje tumor-supresorskog gena
RASSF1 (engl. ras associa on domain family protein 1) za koji je prijašnjim
istraživanjima bilo pokazano da je umiren u zloćudnim tumorima prostate,
ali i drugim vrstama zloćudnih tumora. Spomenutim istraživanje je pokazano
sljedeće: a) umirivanje gena RASSF1 zbog pojačane metilacije promotora
bilo je prisutno u 74% uzoraka zloćudnog tumora i samo 18,5% dobroćudnog,
hipertrofičnog tkiva prostate; b) nivo metilacije dobro je korelirala s
Glieson-zbirom i uznapredovanom bolešću;c) na nemetilirane promotore bili
su vezani acelirani histoni i dimetilirani lizin na histonu 3 (H3K4m2
– dime lacija histona 3 na aminokiseli ni lizin, četvrtoj u slijedu);
d) primjenom inhibitora metilacije molekule DNK (ali ne i inhibitora deacetilaza
histona) došlo je do promjene u modifikaciji histona vezanih uz promotor.
Konačna informacija koja je značajno mijenjala sliku epigenetičkog mozaika
bila je jako zanimljiva:smanjena acetilacija histona, ili dimetilacija
H3K4, udružena s povišenom dimetilacijom lizina, devetog u slijedu aminokiselina
histona H3 (H3K9m2), ima ključnu ulogu u umirivanju gena RASSF1. Na osnovu
ovog rada postalo je očito da ispravna komunikacija na nivou: acetilacija
histona – metilacija molekule DNK predstavlja jako važnu sponu za funkcionisanje
ćelije. Događaje koji prethode njezinom stvaranju tek treba otkriti .
Neko bi se, odmah u početku, mogao zapitati : “Zašto su modifikacije histona
toliko važne?” Dobro je poznato da je molekula DNK u ćelijama eukariota
organizovana u obliku hromatina. Gradivne jedinice hromatina su nukleosomi
koji sadrže 147 parova baza DNK omotanih oko osmodijelnog kompleksa sastavljenog
od po dvije molekule histona H2A, H2B, H3 i H4. Upravo posttranslacijske
promjene u amino-terminalnim dijelovima histona određuju dostupnost hromatina
transkripcijskoj mašineriji, a time i aktivnost gena. No, ni u ovom slučaju
ne znamo tačne mehanizme uspostavljanja ove kaskade događaja. To se naročito
odnosi na razumijevanje mehanizama koji su nužni za uspostavljanje, održavanje
i, najvažnije, mijenjanje obrazaca metilacije ostrvaca CpG i acetilacije
histona. Jasno je, međutim, da se poremećaj ovih obrazaca koji je tako
poznat za zloćudno oboljenje relativno dobro prepoznaje na nivou opisne
fenomenologije.
EPIGENOMSKI LJEKOVI
Sama činjenica, da su epigenomske promjene reverzibilne, otvara mogućnost
novom, epigenomskom liječenju. Nadalje, s obzirom na to da je reverzibilnost
procesa osnov hemoprevencije, epigenomski bi pristup vrlo brzo mogao u
potpunosti promijeniti naše sadašnje shvatanje hemoprevencije. Dakle,
za razliku od dobro znanog konvencionalnog liječenja
raka citostaticima kojima se manje - više neselektivno ubijaju sve
ćelije koje se dijele, epigenomskim bi se pristupom, u idealnim uslovima,
naravno, pokušalo proces“vratiti nazad”. Pritom bi se mogle pratiti pojave
kod bolesnika sprekanceroznim lezijama (nedovoljno istraženo dosada) te
ciljano, uravnoteženjem mreže epigenetskih signala, liječiti ovu grupu
ljudi (slika 1B). Nadalje, možda bi se otkrivanjem ranih epigenomskih-epigenetskih
promjena u naizgled zdravom tkivu mogla predvidjeti sklonost nastanku
bolesti, upravo na tom analiziranom anatomskom mjestu. Znači, u pravilnim
bi se indikacijskim granicama epigenetske analize mogle primijeniti i
u dijagnostičke svrhe i to ne samo, kako se u početku činilo, u području
onkologije.
Trenutno postoje dvije vrste epigenomskih lijekova: inhibitori DNK metiltransferaza
i inhibitori deacetilaza histona. Prva grupa lijekova poznata je i pod
nazivom “demetilatori” koji svoje djelovanje ostvaruju ugradnjom u molekulu
DNK, tokom njene replikacije. Ovo im omogućuje njihova hemijska struktura
po kojoj su vrlo slični nukleoziducitidin. Posljedica njihove ugradnje
u novonastajući lanac molekula DNK je “zarobljavanje” DNK-metiltransferaze,
zbog čega dolazi do gubitka njene aktivnosti, a cijeli sistem postaje
hipometiliran. Trenutno se na tržištu u SAD-u nalaze dva lijeka derivata
citidina hipometilatora, koje je odobrila FDA. Prvi, VidazaTM (5-azacy
dine), odobren je u maju 2004., dok je DacogenTM (5-aza-2’ deoxycy dine),
koji je deoskiriboza - analog 5-azacidina, odobren u maju 2006. Prva indikacija
za primjenu ovih dvaju lijekova je mijelodisplastični sindrom (MDS, engl.
myelodysplas c syndrome). Dok se 5-aza-2’-deoxycytidine veže samo za molekulu
DNK, 5-azacytidine se veže i za molekul RNK, pa negativno utiče na translaciju
u citoplazmi.Oba lijeka svoj terapijski učinak prvenstveno ostvaruju hipometilacijom
promotora gena koji su neophodni za diferencijaciju, ali i direktnim citotoksičnim
učinkom na hematopoetske ćelije u koštanoj srži koje su u potpunosti izgubile
regulatorne mehanizme uključene u kontrolu ćelijskog ciklusa i zbog toga
postale u potpunosti neosjetljve na podražaje fiziološkim signalima rasta.
Neproliferirajuće ćelije su relativno neosjetljive na Vidazu. Potreba
za odobravanjem inhibitora deacetilaza histona bila je logična, s obzirom
na velik broj naučnih dokaza o prekomjernoj aktivnosti deacetilaza histona
u ćelijama raka. Prema tome, osnovna ideja je uvođenje ove grupe lijekova
u kliniku kako bi se, inhibiranjem deacetilaza, podržalo postojanje histona
u njihovom acetiliranom obliku. Ovo bi, spriječilo “umotavanje” molekula
DNK u zgusnutu strukturu koja za posljedicu ima umirivanje gena. Znači,
terapijski bi se učinak trebao zasnivati na reaktiviranju umirenih tumor
– supresorskih gena. Najveći problem s kojim se ovdje srećemo je neselektivnost.
Naime, acetilacija je osnovni biološki proces i primjena ovakvog lijeka
sigurno ima utjecaj na sve signalne puteve koji su regulisani (između
ostalog) acetilacijom. Prema tome, ako i postoji pozitivan terapijski
učinak (a postoji, u protivnom lijek ne bi ni bio odobren na tržištu),
mreža signala na koju utiče je toliko široka da na kraju ne znamo koji
je signalni put bio kritičan u liječenju. Drugim riječima, pravi mehanizam
molekularnog djelovanja u ovom slučaju ostaje sakriven (radi li se “samo”
o inhibiranju deacetilaza histona, ili je konačan terapijski rezultat
nastao zbog slučajnih “nuspojava” širokospektralnog djelovanja lijeka).
Ne smijemo zaboraviti da trenutno poznajemo 11 enzima, članova porodice
HDAC. Ono što je dobro jeste da smo svjesni nesavršenosti terapijskog
pristupa korišćenjem ove grupe lijekova: na primjer vorinostat (ZolinzaTM),
koji je FDA odobrila u oktobru 2006. prvenstveno za liječenje kožnih manifestacija
T-ćelijskog limfoma (CTCL, engl. cutaneous T-cell lymphoma) u oboljelih
od progresivne, stalne ili rekurentne bolesti , prepoznat je kao paninhibitor,
bez toliko potrebne selektivnosti .
Jasno je, dakle, da je jedan od najvažnijih ciljeva koji bi trebao biti
postignut u području epigenomskih lijekova upravo selektivnost. Njihov
hemijski spoj “MGCD0103” koji se trenutno ispituje u klinici “racionalno
dizajniran, moćan i selektivan HDAC- inhibitor pojedinih, specifičnih HDAC-izoformi.
Uistinu, djelovanje ovog antitumorskog lijeka u uslovima in vivo i in
vitro nedavno je i objavljeno. Osim ovog, postoji nekoliko studija čiji
rezultati upućuju na to da bi neki HDAC-inhibitori mogli biti uspješno
primijenjeni i u liječenju Hodgkinova limfoma, akutne mijeloične
leukemije i samog mijelodisplastičnog sindroma. Na primjer, hemijski
spoj proizveden u Novartisu, koji se ispituje pod imenom “LBH589”, pokazao
se izuzetno uspješnim u stimulisanju aktivnosti gena odgovornih za popravak
oštećenja molekule DNK i apoptozu,u ćelijama oboljelih od Ph– akutne limfoblastične
leukemije. Ono što je važno napomenuti je da je kombinovana primjena demetilatora
i inhibitora HDAC već u kliničkim ispitivanjima i rezultati su, barem
za sada, obećavajući. U svakom slučaju, kako broj optimističnih izviještaja
postaje sve veći, ostaje nam da se nadamo, zasluženo i optimistično, da
će epigenomski pristup uistinu obilježiti novu, bolju budućnost u području
liječenja raka, a posebno hemoprevencije. Sada kada se počelo prepoznavanje
početnih mehanizama odgovornih za promijenjenu aktivnosti gena, u “prozoru
vremena” koje nam još uvijek omogućuje vožnju unazad što je, izgleda,
moguće sve dok ne dođe do promjena u strukturi molekule DNK (mutacije),
realno je očekivati da ćemo ovo znanje usmjeriti u pravom smjeru.
PROJEKT EPIGENOM ČOVJEKA
Istraživanje u području epigenomike prepoznato je kao prioritet u cijelom svijetu. Naročito se ističu programi koje finansira Evropska unija, ali do izražaja sve više dolaze i nacionalne inicijative: istraživanje metilacije molekule DNK (HEP – Human Epigenome Project); određivanje strukture hromatina (HEROIC – High-Throughput Epigene cegulatory Organiza on in Chroman); i konačno, liječenje zloćudne bolesti (EPITRON, EPIgene c Treatment of Neoplas c Disease). Istraživanj su pokazala da je raspodjela metiliranih ostrvaca molekule DNK jedinstvena za svakog pojedinca, jedinstvena za svako tkivo, jedinstvena za svaki od analiziranih MHC-lokusa. Već 2004. godine Evropska komisija je pokrenula osnivanje Epigenomske mreže izvrsnosti (engl. The Epigenome Network of Excellence (NoE)),koju su idejno, a potom i djelom ostvarili Thomas Jenuwein (Research Ins tute of Molecular Pathology of Vienna), Phil Avner (Pasteur Ins tute, Pariz) i Genevive Almouzni (Curie Ins tute, Pariz). Primarni je cilj bio stvaranje umreženog epigenomskog istraživanja u Evropi. Zaključak je , da se otpočne s projektom Epigenom čovjeka, s primarnim ciljem: “... da se identifikuju sve hemijske promjene i međusobni odnosi između svih konstitutivnih dijelova hromatina koji utiču na “funkciju koda DNK” (ak vnostgena, op. K. G. T.) kako bi se bolje razumio razvoj, starenje, gubitak kontrole aktivnosti gena u ćelijama raka i drugim bolestima, kao i utjecaj sredine na zdravlje čovjeka”. Glavni zadatak projekta bilo je mapiranje ostrvaca metilacije u molekuli DNK. Primarni cilj im je definisanje epigenomskih markera u određenim tkivima čovjeka na različitim stepenima razvoja. U drugim je djelovima svijeta epigenomika takođe prepoznata kao prioritet. Umreženja različitih grupa naučnika na vrhu su biomedicinskih prioriteta u Aziji, gdje je, na primjer, u decembru 2006. osnovano Japansko društvo za epigenetiku. U Australiji je Australska alijansa za epigenetiku otpočela s radom krajem 2008. godine.
Odgovori na pitanja koja su strukturu gena, njihovu anatomiju, povezala sa sklonošću nastanku određenih bolesti predstavljaju vrh ledenog brijega. Multidisciplinarna istraživanja čiji je zadatak otkriti mehanizme regulacije aktivnosti pojedinih gena, dakle istražiti funkciju, fiziologiju gena, objedinjena su pod nazivom “epigenetika”. Za razliku od “epigenomike” koja objedinjuje globalne analize epigenetičkih promjena cijelog genooma, “epigenetika” analizira promjene tačno određenih gena i/ili grupa gena u zadanom vremenskom i prostornom kontekstu.
5-azaci din i 5-aza-2’-deoksici din se u organizmu brzo razgrađuju. Zebularin, novi analog, stabilniji je i može se primijeniti oralno, pa se očekuje da će on biti baza razvoja nove generacije hipometilatora. Veliki je interes i za razvoj nenukleozidnih inhibitora DNMT, kako bi se izbjegli toksični efekti koji se nužno javljaju nakon ugradnje nukleozidnog analoga u molekulu DNK. Listu nenukleozidnih inhibitora čiji se efekat intenzivno istražuje trenutno čine: prokainamid, prokain, RG-109 i MG-98.
LITERATURA:
1. Esteller M. The necessi y of a human epigenome project. Carcinogenesis 006;27:1121-5.
2. Waddington C. The epigenotype. Endeavour 1942;1:1820.
3. Van Speybroeck L. From epigenesis to epigene cs. AnnNY Acad Sci 2002;981:61-81.
4. Rakayan VK, Blewi ME, Druker R, Preis JI, Whitlaw E.Metastable epialleles in mammals. Trends Genet 2002;18:348-51.
5. Rakayan VK, Chong S, Champ ME, Cuthbert PC, MorganHD, Luu KV et al. Transgenera onal inheritance of epigene c states at the murine Axin(Fu) allele occurs a er maternal and paternal transmissions. Proc Natl Acad SciUSA 2003;100:2538-43.
6. Feinberg AP, Vogelstein B. Hypomethyla on dis nguishes genes of some human cancers from their normal counterparts Nature 1983;301:89-92.
7. Antequera F, Bird A. Number of CpG islands and genes in human and mouse. Proc Natl Acad Sci USA 1993;90:11995-9.
8. Jaenisch R, Bird A. Epigene c regula on of gene expression: how the genome integrate intrinsic and environmental signals. Nat Genet 2003;33(Suppl):245-54.
9. Schubeler D, Lorincz MC, Cimbora DM, Telling A, Feng YQ, Bouhassura EE et al. Genomic targe ng of methylated DNA: influence of methyla on on transcrip on, replica on, chroma n structure, and histone acetyla on. Mol Cell Biol 2000;20:9103-12.
10. Reik W, Kelsey G, Walter J. Dissec ng de novo methylaon. Nat Genet 1999;23:380-2.
11. Bird A. DNA methyla on pa ers and epigene c memory. Genes Dev 2002;16:6-21.
12. Lei H, Oh SP, Okano M, Ju ermann R, Goss KA, Jaenisch R et al. De novo DNA cytosine methytransferase ac vi es in mouse embryonic stem cells. Development 1996;122:3195-205.
13. Li E, Bestor R, Jaenisch R. Targeted muta on of the DNAmethyltransferase gene results in embryonic lethality.Cell 1992;69:915-26.
14. Singal R, Ginder GD. DNA methyla on. Blood. 1999;93:4059-70.
15. Go esfeld JM, Forbes DJ. Mito c repression of the transcrip onal machinery. Trends Biochem Sci 1997;22:197-202.
16. Kawamoto K, Okino ST, Place RF, Urakami S, Hirata H,Kikuno N et al. Epigene c modifica ons of RASSF1A gene through chroma n remodeling in prostate cancer. Clin Cancer Res 2007;13:2541-8.
17. Jain N, Rossi A, Garcia-Manero G. Epigene c therapy of leukemia: an update. Int J Biochem Cell Biol 2009; in press.
18. Fournel M, Bonfils C, Hou Y, Yan PT, Trachy-Bourget MC, Kalita A et al. MGCD0103, a novel isotype-selec ve hi stone deacetylase inhibitor, has broad spectrum an tumor ac vity in vitro and in vivo. Mol Cancer Ther 2008;7:759–68.
19. Scuto A, Kirschbaum M, Kowolik C, Kretzner L, Juhasz A, Atadja P et al. The novel histone deacetylase inhibitor, LBH589, induces expression of DNA damage response genes and apoptosis in Ph - acute lymphoblas c leukemia cells. Blood 2008;111:5093-100.
20. Jain N, Rossi A, Garcia-Manero G. Epigene c therapy of leukemia: an update. Int J Biochem Cell Biol 2009;In press.
21. Rakyan VK, Hildmann T, Novik KL, Lewin J, Tost J, Cox AV et al. DNA methyla on profiling of the human major histocompa bility complex: a pilot study for the human epigenome project. PLoS Biol 2004 D; 2(12): e405 (doi:10.1371/journal.pbio.0020405)
22. The American Associa on for Cancer Research Human Epigenome Task Force and the European Union, Network of Excellence, Scien fic Advisory Board. Moving AHEAD with an interna onal human epigenome project. Science 2008;457:711-5.
23. Jones PA, Mar ensses R. A blueprint for a human epigenome project: The AACR human epigenome workshop. Cancer Res 2005:65:11241-6.
